关于FeCl3进行的实验,下列预测正确的是 ( )
| 选项 |
实 验 |
预 测 |
| A |
蒸发FeCl3溶液 |
得到FeCl3固体 |
| B |
在FeCl3、CuCl2混合液中,加入少量Fe粉 |
一定有H2产生且有Cu析出 |
| C |
用FeCl3固体溶于水配制饱和溶液 |
会有Fe(OH)3沉淀产生 |
| D |
在FeCl3溶液中,加入KHCO3溶液 |
有CO2产生,但无Fe(OH)3沉淀生成 |
下列有关物质检验的操作和实验结论都正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| B |
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 |
该溶液中一定含有Fe2+ |
| C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
| D |
向试管中的溶液加入稀盐酸,产生的无色气体能够使澄清的石灰水变浑浊。 |
该溶液中一定含有CO32- |
下列关于反应类型的关系正确的是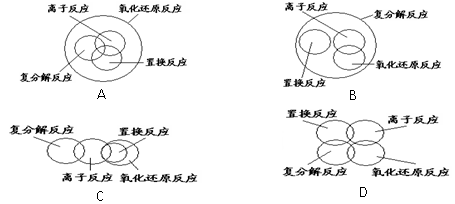
下列实验设计及其对应的离子方程式均正确的是
| A.用FeCl3溶液腐蚀铜线路板:Cu + 2Fe3+=Cu2+ + 2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2 + H2O= 2Na+ + 2OH-+ O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2 + H2O= 2H+ + Cl-+ ClO- |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO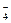 + 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
+ 6H+ + 5H2O2= 2Mn2+ + 5O2↑ + 8H2O
在室温时,下列各组中的物质分别与过量NaOH溶液反应,能生成5种盐的是
| A.A12O3、SO2、CO2、SO3 | B.C12、A12O3、N2O5、SO3 |
| C.CO2、C12、CaO、SO3 | D.SiO2、N2O5、CO、C12 |
下列各图所示的实验原理、方法、装置或操作正确的是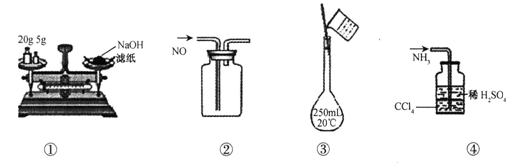
| A.①称量氢氧化钠固体 | B.②收集NO气体 |
| C.③配制100 mL 0.10 mol·L-1盐酸 | D.④吸收NH3时防止倒吸 |