下列推断或表述正确的是 ( )
| A.分别将体积各为1L的1mol/L NaCI溶液和1mol/L的NaF溶液加水稀释至100L,两溶液离子总数相等 |
| B.将pH =a的醋酸溶液稀释100倍,稀释液pH=b,则b=a+2 |
| C.0.2mol/L的盐酸与0.05mol/L的Ba( OH)2溶液等体积混合,混合液pH =1 |
| D.向1L,0.3mol/L的NaOH溶液缓缓通入CO2气体,至溶液质量增加8.8g,则溶液中: |
2c(Na+) 3[c(HCO3-)+c(CO32-)+c(H2CO3)]
向100mLFeBr2溶液中通入标准状况下的C12 3.36 L,C12全部被还原,测得溶液中c(Br–)=c(C1–),则原FeBr2溶液的物质的量浓度是()
| A.2mol/L | B.3 mol/ L | C.1.5 mol/ L | D.0.75mol/L |
将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下列知识正确的是()
A.硫及其化合物的化合价与氧化还原反应的关系: |
B.分散系的分类: |
C.AlCl3溶液与NaOH溶液反应后铝元素的存在形式: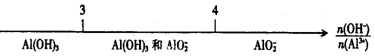 |
| D.CO2与NaOH溶液反应后的产物 |

将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4+ 28HNO3=9Fe(NO3)x+ NO↑+14H2O 。下列判断合理的是()
| A.Fe(NO3)x中的x为2 |
| B.稀HNO3在反应中只作氧化剂 |
| C.反应中每生成0.2 mol 还原产物,有0.6 mol 电子转移 |
| D.磁性氧化铁中的所有铁元素全部被氧化 |
下列各组单质中,前者在一定的条件下能将后者从其化合物中置换出来的是()
①Al、Fe②Cl2、S③Mg、C④H2、Cu⑤C、Si
A.只有①③ B.只有②④ C.只有①②③④ D.①②③④⑤
科学家指出,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物。下列说法不正确的是()
| A.维生素C具有还原性 |
| B.上述过程中砷元素发生还原反应 |
| C.上述过程中+5价砷类物质作氧化剂 |
| D.1 mol +5价砷完全转化为+3价砷,失去2 mol电子 |