下列有机反应的产物中不可能存在同分异构体的是( )
| A.CH3CH=CH2与HCl加成 |
| B.CH3CH2CH2Cl在碱性溶液中水解 |
| C.CH2=CH—CH=CH2与H2按物质的量之比1:1反应 |
D.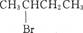 与NaOH醇溶液共热 与NaOH醇溶液共热 |
下列有关二氧化硫的说法中,错误的是
| A.二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3 |
| B.二氧化硫能漂白某些物质,说明它具有氧化性 |
| C.将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性 |
| D.实验室可用浓硫酸干燥二氧化硫气体 |
设NA为阿伏加德罗常数,下列叙述中正确的是
| A.标准状况下,2.24LCH4所含质子数为0.1NA |
| B.0.1mol Fe与足量氯气反应转移的电子数为0.2NA |
| C.0.1mol C8H18分子中共价键总数为2.5NA |
| D.100mL 1mol/L醋酸溶液中离子总数为0.2NA |
可逆反应:2NO2(g) 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③分别用NO2、NO、O2的物质的量浓度变化表示的反应速率为2:2:1的状态
④混合气体颜色不再改变的状态
⑤混合气体密度不再改变的状态
⑥混合气体相对分子质量不再改变的状态
| A.①④⑥ | B.②③⑤ | C.①③④ | D.①②③④⑤⑥ |
在铁的氧化物和氧化铝组成的混合物中,加入2mol/L硫酸溶液65mL,恰好完全反应。所得溶液中Fe2+能被标准状况下112mL氯气氧化。则原混合物中金属元素和氧元素的原子个数之比为
| A.5 : 7 | B.4 : 3 | C.3 : 4 | D.9 : 13 |
下列反应中,有沉淀产生且不会消失的是
| A.向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量 |
| B.将NaOH溶液逐滴滴入AlCl3溶液中,直至过量 |
| C.向AlCl3溶液中逐滴滴入稀硫酸 |
| D.将氨水逐滴滴入硝酸银溶液中,直至过量 |