可逆反应:2NO2(g) 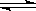 2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是 ( )
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是 ( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
| A.①④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
糖类、油脂和蛋白质是维持人体生命活动所必需的三大营养物质。以下叙述不正确的是
| A.适当地摄入一定量的油脂,能促进脂溶性维生素的吸收 |
| B.淀粉水解的最终产物是葡萄糖 |
| C.葡萄糖在人体内发生氧化反应能放出大量热量 |
| D.淀粉、纤维素、油脂、蛋白质都是高分子化合物 |
坏血病患者应该多吃的食物是
| A.水果和蔬菜 | B.鱼肉和猪肉 |
| C.鸡蛋和鸭蛋 | D.糙米和肝脏 |
下列材料属于复合材料的是
| A.合成树脂 | B.人造羊毛 | C.钢化玻璃 | D.玻璃钢 |
关于合理饮食有利于健康的下列说法正确的是
| A.缺乏维生素C的人应该多吃动物肝脏 |
| B.饮用水越纯净越好 |
| C.养成良好的饮食习惯,多吃蔬菜、水果等碱性食物 |
| D.调味剂和营养强化剂加得越多越好 |
下列物质中,主要成分不是硅酸盐的是
| A.陶瓷 | B.石英 | C.玻璃 | D.水泥 |