下列化学用语正确的是
A.乙烯分子的电子式 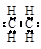 |
B.硫原子的结构示意图  |
| C.淀粉的化学式 (C6H10O5)n |
| D.硫酸铁的电离方程式 Fe2(SO4)3 = 2Fe2+ + 3SO42ˉ |
W、X、Y、Z为原子序数依次增大的短周期元素。W和X原子序数之和等于 的核外电子数,化合物 可用作化学电源的电解质。下列叙述正确的是( )
| A. |
X和Z属于同一主族 |
| B. |
非属性: |
| C. |
气态氢化物的稳定性: |
| D. |
原子半径: |
四瓶无色溶液 、 、 、 ,它们之间的反应关系如图所示。其中a、b、c、d代表四种溶液,e和g为无色气体,f为白色沉淀。下列叙述正确的是( )

| A. |
a呈弱碱性 |
| B. |
f可溶于过量的b中 |
| C. |
c中通入过量的e可得到无色溶液 |
| D. |
b和d反应生成的沉淀不溶于稀硝酸 |
我国化学工作者开发了一种回收利用聚乳酸( )高分子材料的方法,其转化路线如下所示。

下列叙述错误的是( )
| A. |
在碱性条件下可发生降解反应 |
| B. |
的化学名称是丙酸甲酯 |
| C. |
的同分异构体中含羧基的有 种 |
| D. |
可加聚生成高分子 |
下列过程对应的离子方程式正确的是( )
| A. |
用氢氟酸刻蚀玻璃: |
| B. |
用三氯化铁溶液刻制覆铜电路板: |
| C. |
用硫代硫酸钠溶液脱氯: |
| D. |
用碳酸钠溶液浸泡锅炉水垢中的硫酸钙: |
人类对能源的利用经历了柴薪、煤炭和石油时期,现正向新能源方向高质量发展。下列有关能源的叙述错误的是( )
| A. |
木材与煤均含有碳元素 |
B. |
石油裂化可生产汽油 |
| C. |
燃料电池将热能转化为电能 |
D. |
太阳能光解水可制氢 |