下列离子方程式书写正确的是
| A.铁溶于盐酸中2Fe + 6H+ = 2Fe3+ + 3H2↑ |
| B.碳酸钠与硫酸溶液反应 CO32ˉ + H+ = CO2↑+ H2O |
| C.二氧化硫被烧碱溶液吸收SO2 +2OHˉ= SO32ˉ + H2O |
| D.铜与稀硝酸反应 Cu + 8H+ + 2NO3ˉ= Cu2+ + 2NO↑ + 4H2O |
向含有c(FeCl3)="0.2" mol·L-l、c(FeCl2)="0.1" mol·L-l的混合溶液中滴加稀NaOH溶液,可得到一种黑色分散系,其中分散质粒子是直径约为9.3 nm的金属氧化物,下列有关说法中正确的是
| A.该分散系的分散质为Fe2O3 |
| B.加入NaOH时发生的反应可能为:Fe2+ + 2Fe3+ + 8OH- = Fe3O4 + 4H2O |
| C.在电场作用下,阴极附近分散系黑色变深,则说明该分散系带正电荷 |
| D.可用过滤的方法将黑色金属氧化物与Na+分离开 |
下列化学用语正确的是
| A.乙烯的结构简式:CH2CH2 | B.次氯酸的结构式:H – Cl-O |
C.原子结构示意图: 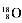 |
D.NH4+ 的电子式: |
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
| A.“洧水”的主要成分是油脂 |
| B.“洧水”的主要成分是煤油 |
| C.烟的主要成分是炭黑 |
| D.烟的主要成分是石墨 |
下列关系式中,正确的是
| A.等浓度等体积的CH3COOH和CH3COONa溶液混合:c(CH3COO- )+c(OH -)=c(H+)+c(CH3COOH) |
| B.常温下,0.1 mol·L-1 HA溶液与0.1 mol·L NaOH溶液等体积完全反应时,溶液中一定存在:c(Na+)=c(A- )>c(OH )=c(H+) |
| C.常温下,0.1 mol·L-1 Na2S溶液中存在:c(OH- )=c(H+)+c(HS- )+c(H2S) |
| D.常温下,将0.1 mol·L-1 CH3COOH溶液加水稀释,当溶液的pH从3.0升到5.0时,溶液中c(CHCOO-)/c(CHCOOH)的值增大到原来的100倍 |
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g)  3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示。下列推断正确的是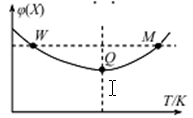
| A.Q点时,Y的转化率最大 |
| B.升高温度,平衡常数增大 |
| C.W点X的正反应速率等于M点X的正反应速率 |
| D.平衡时充入Z,达到新平衡时Z的体积分数增大 |