(1)南京“青奥会”已进入倒计时,体育场馆和城市交通建设日臻完善。
①体育场馆建设需大量建筑材料。下列材料不属于硅酸盐材料的是 (填字母)。
a.石灰石 b.水泥 c.玻璃
②轨道交通建设需大量金属材料。下列金属材料最易发生腐蚀的是 (填字母)。
a.铝合金 b.钢铁 c.纯铜
③“塑胶”跑道是由聚氨酯橡胶等材料建成。聚氨酯橡胶属于 (填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
(2)“青奥会”期间,要保障运动员的营养与健康。
①及时补充体能是运动员取得优秀成绩的基本保证。六大基本营养素中能在人体内氧化供能的有糖类、 和 。
②水果和蔬菜富含VC。已知VC的结构为  ,其分子式为
,其分子式为
;在氯化铁溶液中加入VC溶液后,溶液由黄色转变为浅绿色,说明VC具有较强的____性。
③服用违禁药物不仅妨碍体育竞技的公平、公正,也有害运动员的身心健康。在阿斯匹林、青霉素、麻黄素、小苏打等常用药物中,参赛选手不可服用的是 。
(3)“绿水蓝天”工程为运动员提供优良环境,向世界展示古都南京的美好形象。
①PM2.5指悬浮于大气中的直径≤2.5μm(微米)的颗粒物,大量PM2.5会造成灰霾天气,危害人体健康。燃煤气化有助于控制PM2.5的含量,写出焦炭与水蒸气反应的化学方程式 。
②汽车尾气中含有污染大气的NO和CO。给汽车排气管加装“催化转化器”,可使CO和NO反应生成无毒无污染的气体,反应的化学方程式为 。装有“催化转化器”的汽车必须使用无铅汽油,其原因是 。
③含铬元素的废水必须治理达标。某兴趣小组探究含铬(Cr2O72ˉ)废水的处理方法,经查阅资料,拟采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的氧化还原法和 。指导老师指出该方案处理后的废水中因含有大量 (填离子符号),能导致水体富营养化。
(6分)A、B、C、D、E、F、G均为短周期元素,它们在周期表中的位置如图所示。
请按要求回答下列问题。
| A |
|||||||
| D |
E |
||||||
| B |
C |
F |
G |
(1)A单质的收集方法为。
(2)上述元素形成的单质中,还原性最强的是(填写元素符号)。
(3)E元素是非金属性最强的元素,其阴离子的结构示意图是。
(4)F、G元素的最高价氧化物对应水化物的酸性强弱顺序是(填化学式)。
(5)B元素的最高价氧化物对应水化物与C元素的最高价氧化物对应水化物相互间反应的化学方程式是。
将下列物质进行分类:
①10B与11B ②O2和O3 ③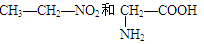
④C60和金刚石 ⑤冰和水 ⑥CH3—CH2—OH和CH3—O—CH3 ⑦ 1H+ 和2H—
(1)互为同位素的是_________(2)互为同素异形体的是____________
(3)互为同分异构体的是___________(4)属于同一化合物的是____________
(I)将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题: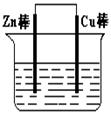
(1)若电解质溶液为稀硫酸,则Zn棒为原电池的极,可观察到Cu棒上产生现象是,试用电极反应式表示该现象:。
(2)若电解质为硫酸铜溶液,则Cu棒上发生反应(填“氧化”“还原”),Zn棒上发生反应的电极反应式为:。
(3)若在上述两个过程中,Zn棒减少的质量相等,则Cu棒上(1)和(2)所析出物质的质量之比为:。
(II)A、B、C三个烧杯中分别盛有500mL相同物质的量浓度的稀硫酸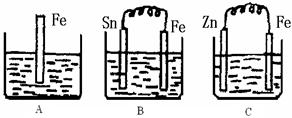
(1)写出A中离子反应方程式:
(2)一段时间后,B中Sn极附近溶液的pH(填“增大”、“减小”、“不变”)。
(3)一段时间后,C中产生了5.6L(标准状况)气体时,硫酸恰好全部被消耗,则原稀硫酸溶液的物质的量浓度为
(4)反应完成后三个烧杯中液体质量大小顺序为:ABC (用<、=、>连接)。
A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,A元素原子失去1个电子后变为质子,B元素原子的最外层电子数比次外层电子数多2个, C元素原子的最外层电子数是次外层电子数的3倍,D元素原子最外层电子数为1,E元素原子的最高价与负价的绝对值之差为4。试回答:
(1)E元素在元素周期表中的位置是
(2)由A、C二种元素共同组成的化合物中既含极性键又含非极性键的是,
只含极性键的是(填化学式)。
(3)D与E可形成化合物,用电子式表示该化合物
(4)用电子式表示B、C两元素形成稳定化合物的过程
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为。
(2)反应开始至2min,以气体Z表示的平均反应速率为。
(3)若X、Y、Z均为气体,2min后反应达到平衡,反应达平衡时:
①此时体系的压强是开始时的倍;
②达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________(填“增大”“减小”或“相等”)。