下列关于碱金属的叙述中不正确的是( )
| A.碱金属元素的阳离子的氧化性随着原子序数的递增依次增强 |
| B.钾与氧气或水反应比钠的反应剧烈,铷、铯的反应更剧烈 |
| C.碱金属元素形成的单质的熔点随原子序数的递增而降低 |
| D.随着核电荷数的递增,他们最高价氧化物对应水化物的碱性逐渐增强 |
下列说法正确的是()
| A.需要加热的化学反应都是吸热反应 |
| B.中和反应都是放热反应 |
| C.原电池是将电能转化为化学能的装置 |
| D.水力发电是将化学能转化成电能的过程 |
在一定温度和压强条件下发生了反应:CO2(g)+3H2 (g)  CH3OH(g)+H2O(g) △H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是()
CH3OH(g)+H2O(g) △H<0,反应达到平衡时,改变温度(T)和压强(p),反应混合物CH3OH“物质的量分数”变化情况如图所示,关于温度(T)和压强(p)的关系判断正确的是()
| A.P3>P2 T3>T2 |
| B.P2>P4 T4>T2 |
| C.P1>P3 T3>T1 |
| D.P1>P4 T2>T3 |
电化学降解NO3-的原理如图所示,若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为a克,则a值为()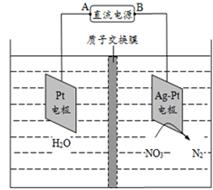
| A.14.4 | B.10.4 | C.12.4 | D.14.0 |
近年来,科学家研制了一种新型的乙醇电池,它用酸性电解质(H+)作溶剂。电池总反应为:C2H5OH+3O2=2CO2+3H2O,下列说法不正确的是()
| A.乙醇在电池的负极上参加反应 |
| B.1mol CH3CH2OH被氧化转移6mole- |
| C.随着反应的进行,正极附近的酸性减弱 |
| D.电池正极的正极反应为4H++O2+4e-=2H2O |
NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.电解硫酸时,阳极产生1molH2时,阴极一定产生0.5molO2 |
| B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol |
| C.电解1mol熔融的Al2O3,能产生33.6L氧气、54.0g金属铝 |
| D.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上就溶解0.5NA个铜原子 |