在NH4+离子中存在4个N-H共价键,则下列说法正确的是( )
| A.四个共价键的键长完全相同 |
| B.四个共价键的键长完全不同 |
| C.原来的三个N-H的键长完全相同,但与由配位键形成的N-H键不同。 |
| D.四个N-H键键长相同,但键能不同 |
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中错误的是()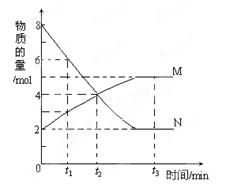
A.反应的化学方程式为:2N M M |
| B.t3时,正反应速率大于逆反应速率 |
C. t1时,N的浓度是M浓度的2倍 t1时,N的浓度是M浓度的2倍 |
| D.t2时,正逆反应速率相等,达到平衡 |
关于NaHCO3溶液的表述正确的是()
| A.c( Na+) = c( HCO3-) + c( CO32-) + c( H2CO3 ) |
| B.c( Na+ ) + c( H+) = c( HCO3-) + c( CO32-) +c( OH- ) |
| C.HCO3-的电离程度大于HCO3-的水解程度 |
D.存在的电离平衡有: HCO3— H++CO3 H++CO3 2—,H2O 2—,H2O  H++OH— H++OH— |
用标准盐酸滴定未知浓度的NaOH溶液时,测定结果偏高,则产生误差的原因可能是()
| A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗 |
| B.酸式滴定管用蒸馏水洗后,未用盐酸润洗 |
| C.滴定前,滴定管尖端处有气泡,而在滴定后滴定管尖端处气泡消失 |
| D.滴定前仰视读取了酸式滴定管的读数,滴定后读数正确 |
在25℃时,某溶液中由水电离出的c(H+)=1×10-12mol/L,则该溶液的pH可能是()
| A.12 | B.7 | C.6 | D.2 |
下列说法不正确的是( )
| A.0.2 mol·L-1的NaHCO3溶液中:c ( Na+ ) > c ( HCO3—) > c ( OH—) >c ( H+ ) |
| B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸需加入的水多 |
| C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c ( NH4+ ) =" c" ( Cl—) |
| D.浓度相同的NaOH溶液与醋酸溶液等体积混合后所得溶液的pH=7 |