把0.6 mol X气体和0.4 mol Y气体混合于容积为2 L的容器中,使其发生如下反应:3X(g)+Y(g) nZ(g)+2W(g)。5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为( )
nZ(g)+2W(g)。5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol·(L·min)-1,则n的值为( )
| A.4 | B.3 | C.2 | D.1 |
200 ℃时,11.6 g CO2和水蒸气的混合气体与足量的Na2O2充分反应,反应后固体质量增加了3.6 g,则原混合气体的平均式量为()
| A.5.8 | B.11.6 | C.23.2 | D.46.4 |
标准状况下,6.72 L Cl2和元素R完全反应,生成0.2 mol RCln,则n值是( )
| A.1 | B.2 | C.3 | D.4 |
配制100 mL 0.1 mol·L-1 Na2CO3溶液,下列操作正确的是()
| A.称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容 |
| B.称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解 |
| C.转移Na2CO3溶液时,未用玻璃棒,直接倒入容量瓶 |
| D.定容后,塞好瓶塞,反复倒转,摇匀 |
图中横坐标表示完全燃烧时耗用可燃气体X(X=A、B、C)的物质的量n(X),纵坐标表示消耗O2的物质的量n(O2),A、B是两种可燃气体,C是A和B的混合气体,则C中n(A)∶n(B)为()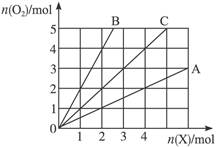
A.2∶1 B.1∶2 C.1∶1 D.任意比
下列曲线图(纵坐标为沉淀的量,横坐标为加入物的量)与对应选项不正确的是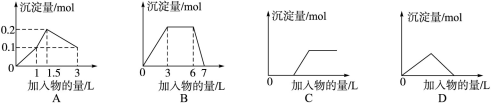
| A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、Na[Al(OH)4]混合液中加入0.1 mol·L-1稀H2SO4溶液 |
| B.向含有0.1 mol·L-1 AlCl3和0.3 mol·L-1 NH4Cl的1 L混合液中加入0.1 mol·L-1 NaOH溶液 |
| C.向烧碱溶液中滴加明矾溶液 |
| D.向Ca(OH)2溶液中逐渐通入二氧化碳 |