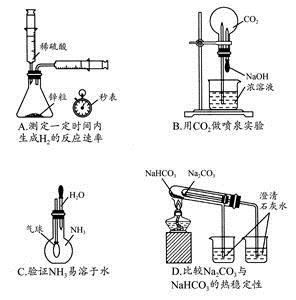
下列各组材料中,不能组成原电池的是:
| |
A |
B |
C |
D |
| 两极材料 |
Zn片、石墨 |
Cu片、Ag片 |
Zn片、Cu片 |
Fe片、Cu片 |
| 插入溶液 |
稀硫酸 |
硝酸银溶液 |
蔗糖溶液 |
稀盐酸 |
关于下列各实验装置图的叙述中,正确的是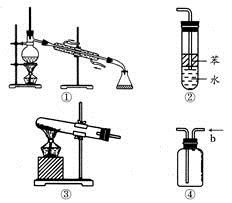
| A.装置①可用于分离沸点不同且互溶的液体混合物 |
| B.装置②可用于吸收HCl气体,并防止倒吸 |
| C.以NH4Cl为原料,装置③可用于实验室制备少量的NH3 |
| D.装置④中从b口进气可用排水法收集NO2、CO等气体 |
下列实验方案不能达到实验目的的是
| 实验目的 |
实验方案 |
|
| A |
证明溴乙烷发生消去反应有乙烯生成 |
向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B |
证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 |
向2 mL 1mol/L NaOH溶液中先加入3滴1 mol/L MgCl2溶液,再加入3滴1 mol/L FeCl3溶液 |
| C |
检验蔗糖的水解产物具有还原性 |
向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D |
测定铝箔中氧化铝的含量 |
取a g铝箔与足量稀盐酸充分反应,逸出的气体通过碱石灰后,测其体积为b L(已转化为标准状况下) |
下列装置所示的实验不能达到目的的是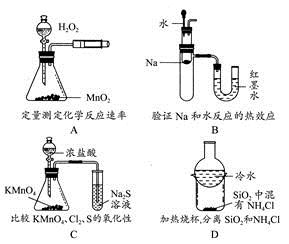
某课外实验小组设计的下列实验不合理的是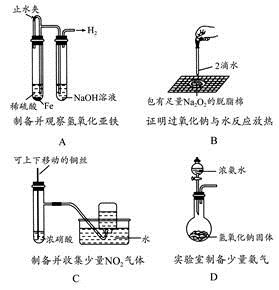
下列实验不能达到目的的是