相同状况下:H2(g)+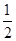 O2(g)===H2O(g) ΔH=-Q1kJ/mol;
O2(g)===H2O(g) ΔH=-Q1kJ/mol;
2H2(g) +O2(g)===2H2O(l) ΔH=-Q2kJ/mol
则Q1和Q2的关系为:
| A.Q1>Q2 | B.Q1=Q2 | C.2Q1<Q2 | D.Q1=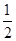 Q2 Q2 |
NA为阿伏加德罗常数,下列叙述中正确的是 ()
| A.0.1 mol PCl3中形成共价键的电子数是0.3NA |
| B.100 mL 1 mol/L NaHSO4溶液中HSO4—数是0.1NA |
| C.标准状况下,11.2 L CO2和O3混合气体中含有的原子数是1.5 NA |
| D.17 g H2O2完全分解,转移电子数是1NA |
下列化学反应的离子方程式正确的是()
| A.次氯酸钠漂液中加浓盐酸产生氯气:ClO- + Cl-+2H+=Cl2↑+H2O |
| B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
| C.用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑ |
| D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O |
把0.6 mol X气体和0.4 mol Y气体混合于容积为2 L的容器中,使其发生反应3X(g)+Y(g)===nZ(g)+2W(g).5 min末生成0.2 mol W,若测知以Z浓度变化表示的平均反应速率为0.01 mol/(L·min),则n的值为
| A.1 | B.2 | C.3 | D.4 |
下列变化规律错误的是()
| A.微粒半径:F –<Cl–< Br– < I – | B.稳定性:HI< HBr <HCl< HF |
| C.沸点:HF< HCl < HBr< HI | D.阴离子还原性:F– < Cl– < Br– < I– |
下列叙述中正确的是(NA为阿伏加德罗常数)()
| A.通常状况下将0.5mol HI气体和0.5 mol Cl2混合后,气体的分子数小于NA |
| B.同温同压下,相同体积的物质,其物质的量必相等 |
| C.5.3g Na2CO3固体含有的离子数为1.5NA |
| D.标准状况下,0.5 NA个Br2所占的体积约为11.2L |