下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+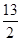 O2(g)===4CO2(g)+5H2O(l) ΔH=-2878 kJ/mol
O2(g)===4CO2(g)+5H2O(l) ΔH=-2878 kJ/mol
②C4H10(g)+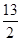 O2(g)===4CO2(g)+5H2O(g) ΔH=-2658 kJ/mol
O2(g)===4CO2(g)+5H2O(g) ΔH=-2658 kJ/mol
③C4H10(g)+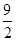 O2(g)===4CO(g)+5H2O(l) ΔH=-1746 kJ/mol
O2(g)===4CO(g)+5H2O(l) ΔH=-1746 kJ/mol
④C4H10(g)+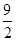 O2(g)===4CO(g)+5H2O(g) ΔH=-1526 kJ/mol
O2(g)===4CO(g)+5H2O(g) ΔH=-1526 kJ/mol
由此判断,正丁烷的燃烧热是:
| A.-2878 kJ/mol | B.-2658 kJ/mol |
| C.-1746 kJ/mol | D.-1526 kJ/mol |
设NA为阿伏加德罗常数的值,下列说法中正确的是
| A.1mol乙基中含有的电子数为17NA |
| B.标准状况下,22.4L三氯甲烷中共价键数目为4NA |
| C.1mol硫粉与足量的Cu粉共热,转移的电子数为1NA |
| D.7.8gNa2O2晶体中含有阴阳离子总数为0.4NA |
下列有关化学用语书写正确的是
①蔗糖的最简式是CH2O②次氯酸的结构式:H—Cl—O
③苯甲醇的结构简式: -CH2OH④甲烷分子的比例模型:
-CH2OH④甲烷分子的比例模型:
⑤S2-的电子排布图为:1s22s22p63s23p6⑥原子核内有10个中子的氧离子: 2-
2-
| A.②③⑥ | B.③⑥ | C.①③⑤⑥ | D.①②③④⑤⑥ |
关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是
| A.取等体积的两种酸溶液分别进行稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n |
| B.取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 |
| C.取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多 |
| D.两种酸溶液中c(CH3COO-)=c(Cl-) |
常温时,一定能大量共存的离子组是
| A.能与Al反应生成H2的溶液中:Ca2+、NH4+、HCO3-、Cl- |
| B.能使甲基橙呈红色的溶液中:Na+、Mg2+、Br-、SO42- |
| C.pH=12的溶液中:Mg2+、K+、Cl-、NO3- |
| D.由水电离出的c(H+)=10-12mol/L的溶液中:K+、Ba2+、ClO-、CO32- |
将0.10mol/L的AlCl3溶液10mL与0.10mol/L的KOH溶液40mL充分混和,所得溶液中各种微粒的物质的量浓度关系正确的是
| A.c(K+)>c(Cl-)>c(AlO2-)>c(OH-)>c(H+) |
| B.c(K+)>c(Cl-)>c(AlO2-)>c(H+)>c(OH-) |
| C.c(Cl-)>c (K+)>c(OH-)>c(AlO2-)>c(H+) |
| D.c(Cl-)>c(K+)>c(AlO2-)>c(OH-)>c(H+) |