甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); ΔH=" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1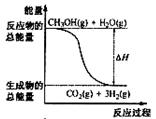
下列说法正确的是
| A.CH3OH的燃烧热为—192.9 kJ·mol-1 |
| B.反应①中的能量变化如右图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的ΔH>-192.9kJ·mol-1 |
下列叙述中错误的是:
| A.H2SO4的摩尔质量是98 |
| B.2mol N2O和2mol NO2含原子数相同 |
| C.等质量的O2和O3中所含氧原子个数相同 |
| D.等物质的量的CO和CO2中所含碳原子数相等 |
如果1 g水中含有n个氢原子,则阿伏加德罗常数是:
| A.n/1mol-1 | B.9n mol-1 | C.2nmol-1 | D.nmol-1 |
0.5 mol Na2SO4中所含的Na+ 离子数约为:
| A.3.01×1023 | B.6.02×1023 | C.0.5 | D.1 |
设NA为阿伏加德罗常数,下列说法正确的是:
| A.NA个氧分子与NA个氢分子的质量比是16:1 |
| B.18克水所含电子数为NA |
| C.19.6 g硫酸所含的硫原子数为0.1 NA |
| D.2.4 g镁变成镁离子时,失去电子数目为0.1 NA |
下列关于阿伏加德罗常数的说法正确的是:
| A.阿伏加德罗常数是12 g 14C中所含的碳原子数 |
| B.阿伏加德罗常数是 0.012 kg 12C中所含的质子数 |
| C.阿伏加德罗常数是6.02×1023 mol-1 |
| D.阿伏加德罗常数的符号为NA,近似值为6.02×1023 mol-1 |