碘在科研与生活中有重要作用,某兴趣小组用0.50 mol·L—1KI、0.2%淀粉溶液、0.20 mol·L—1K2S2O8、0.10 mol·L—1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。已知:S2O82—+ 2I— =" 2" SO42— + I2(慢) I2 + 2 S2O32— = 2I— + S4O62—(快(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32—与S2O82—初始的物质的量需满足的关系为:n(S2O32—):n(S2O82—) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 |
体积V/ml |
||||
| K2S2O8溶液 |
水 |
KI溶液 |
Na2S2O3溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中Vx = ml,理由是 。
(3)已知某条件下,浓度c(S2O82—)随反应时间t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82—)随反应时间t的变化曲线示意图(进行相应的标注)。
(4)碘也可用作心脏起搏器电源—锂碘电池的材料,
该电池反应为:2 Li(s) + I2 (s) =" 2" LiI(s) ΔH
已知:4 Li(s) + O2 (g) =" 2" Li2O(s) ΔH1
4 LiI(s) + O2 (g) =" 2" I2 (s) + 2 Li2O(s) ΔH2
则电池反应的ΔH = ;还原剂是 。
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程: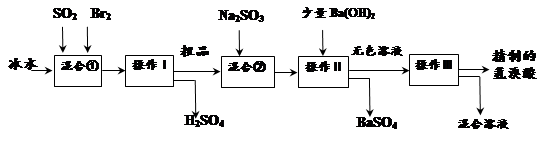
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为。
(2)溴与氯能以共价键结合形成BrCl,BrCl的性质与卤素单质相似。则BrCl与水发生反应的化学方程式为。
(3)操作Ⅱ的名称是。操作Ⅲ一般适用于分离____________混合物。(选填编号)
| A.固体和液体 | B.固体和固体 | C.互不相溶的液体 | D.互溶的液体 |
(4)混合②中加入Na2SO3的目的是。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为,若假设成立可观察到的现象为。乙同学假设工业氢溴酸呈淡黄色是因为_______,其用于证明该假设所用的试剂为。
(10分)下图所示是用于气体制备、干燥(或除杂质)、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去,各装置可重复使用也可不用)。请根据下列要求回答问题。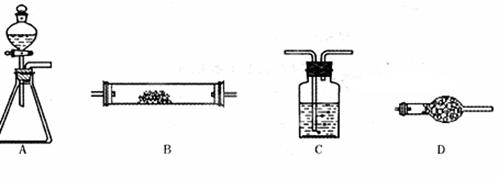
(1)若用A-C-D-B组合进行氢气还原氧化铜实验。分液漏斗中的试剂是盐酸,C中试剂是水,其作用是;A中反应开始一段时间后,再加热B。加热B之前的实验操作是。
(2)为验证氯气不能使干燥的红布条褪色,置红布条于B中,按A-C-B-D连接成实验装置体系。A锥形瓶中试剂选用高锰酸钾晶体,则分液漏斗中的液体是(填名称);C中试剂是(填名称)。已知高锰酸钾反应生成+2价的锰离子,写出此法制备氯气的离子方程式。
(3)为了进行氨的催化氧化实验,若锥形瓶中盛装足量的Na2O2粉末,分液漏斗中盛装浓氨水,慢慢打开分液漏斗的活塞,产生的气体通过红热的铂粉,各仪器装置按气流方向从左到右连接顺序是;(填字母)装置B中发生反应的化学方程式为。
6分)制备Cl2需用8 mol•L-1的盐酸100mL,现用12 mol•L-1的盐酸来配制。
①需要12 mol•L-1的盐酸的体积为mL(精确到0.1 mL)
②为完成配制,除玻璃棒,小烧杯外,还需要选择的仪器为。
A 100mL量筒 B托盘天平 C 100mL容量瓶 D.50mL容量瓶
E.10mL量筒 F.胶头滴管
③ 在容量瓶的使用方法中,下列操作中,不正确的是(填写标号)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C. 配制溶液时用量筒量取浓盐酸后用玻璃棒引流入容量瓶中,缓慢加入蒸馏水到接近刻度线1cm~2cm处,用胶头滴管滴加蒸馏水直到凹液面的最低处和标线相平
D.定容后盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次
【化学——选修2:化学与技术】硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:
已知几种盐的溶解度随温度变化的曲线如图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是______________。
(2)煅烧 FeCO3生成产品 I的化学反应方程式为 _______。实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是:__________________。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液______________。
甲、乙两同学欲分别完成“钠与氯气反应”的实验.
I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热.待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图I).该方案的不足之处有:
_______________________________(至少答出两点).
II.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为 _________________________________ ;待装置中出现_____________现象后,点燃酒精灯.
(2)点燃酒精灯后,玻璃管中出现的现象是_______________________________(至少答出两点)
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积.
①若图Ⅲ所示量气装置由干燥管、乳胶管和50mL滴定管组装而成,此处所用滴定管是______(填“酸式”或“碱式”)滴定管.
②为提高测量的准确性,图Ⅲ装置中的液体可用______________;收集完气体并冷却至室温后读数,读数前应进行的操作是_______________.
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积______(填“偏大”、“偏小”或“无影响”).