一个原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池的正确组成是
| |
A |
B |
C |
D |
| 正极 |
Zn |
Cu |
Zn |
Fe |
| 负极 |
Cu |
Zn |
A g |
Zn |
| 电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
CuCl2 |
下列说法正确的是
| A.铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应 |
| B.硅在电子工业中是最重要的半导体材料,广泛用于制作光导纤维 |
| C.二氧化硫是一种有毒气体,所以不能用于杀菌消毒 |
| D.氨很容易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
下列有关物质的性质与应用不相对应的是
| A.Na2O2能分别与H2O、CO2反应产生氧气,可用作供氧剂 |
| B.硅胶多孔、吸水能力强,常用作袋装食品的干燥剂 |
| C.K2FeO4具有强还原性且被氧化生成Fe3+,可用于水的消毒和净水 |
| D.液氨气化时能吸收大量的热,使周围温度急剧降低,因此可用作制冷剂 |
下列关于物质的用途或变化,说法正确的是
| A.Al2O3熔点很高,可用作耐火材料 |
| B.高纯度的硅单质用于制作光导纤维 |
| C.铝热反应是炼铁最常用的方法 |
| D.N2与O2在放电条件下直接化合生成NO2 |
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是: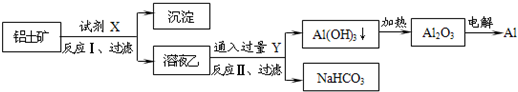
| A.试剂X为稀硫酸,沉淀中含有硅的化合物 |
| B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
| C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2- |
| D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al |
下列说法正确的是
| A.二氧化硫可广泛用于食品的增白 |
| B.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 |
| D.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |