水和重水分别跟金属钾反应,若两反应中电子转移总数相等时,下列物质的化学量相等的是:①消耗水和重水的质量;②同温同压下生成气体的体积;③生成气体的质量; ④参加反应的钾的质量。
| A.①③ | B.②④ | C.①④ | D.②③ |
反应CO+H2O(g) CO2+H2在1000 K达到平衡时,分别改变下列条件,K值发生变化的是
CO2+H2在1000 K达到平衡时,分别改变下列条件,K值发生变化的是
| A.将压强减小至原来的一半 | B.将反应温度升高至1200 K |
| C.添加催化剂 | D.增大水蒸气的浓度 |
在一支25mL的酸式滴定管中盛入0.1mol·L-1HCl溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.lmol·L-1NaOH溶液进行滴定,则所需NaOH溶液的体积
| A.大于20 mL | B.小于20 mL | C.等于20 mL | D.等于5mL |
用物质的量都是0.1mol的HCN和NaCN混合后配成1L溶液,已知溶液中的c(CN-)<c(Na+),下列关系式正确的是
| A.c(H+)>c(OH-) | B.c(HCN)<c(CN-) |
| C.c(CN-)+c(OH-)=0.1mol·L-1 | D.c(HCN)+c(CN-) = 0.2mol·L-1 |
在密闭容器中发生反应:aX(g)+bY(g)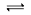 cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述中不正确的是
| A.平衡向逆反应方向移动 | B.a + b > c + d |
| C.Z的体积分数减小 | D.X的转化率下降 |
反应速率v和反应物浓度的关系是用实验方法测定的,化学反应H2+Cl2=2HCl的反应速率v可表示为v=K[c(H2)]m[c(Cl2)]n,式中K为常数,m、n值可用下表中数据确定之。
| c(H2)(mol·L-1) |
c(Cl2)(mol·L-1) |
v(mol·L-1·s-1) |
| 1.0 |
1.0 |
1.0K |
| 2.0 |
1.0 |
2.0K |
| 2.0 |
4.0 |
4.0K |
由此可推得,m、n值正确的是
A.m=1,n=1 B.m=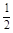 ,n=
,n=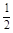 C.m=
C.m=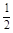 ,n=1 D.m=1,n=
,n=1 D.m=1,n=