下列关于化学键的说法正确的是:
①HF是一种非常稳定的化合物,这是因为分子间存在氢键
②NaCl熔化离子键发生了破坏
③CO2、SiO2熔点后者高是因为前者克服分子间作用力后者熔化破坏共价键
④活泼金属与非金属化合时,一定能形成离子键
⑤离子化合物中可能同时含有离子键和共价键
⑥由非金属元素形成的化合物一定不是离子化合物
⑦单质分子中一定含非极性键
| A.①②⑤ | B.④⑥⑦ | C.①③④ | D.②③⑤ |
下列溶液中一定能大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH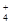 、SO 、SO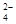 、Cl- 、Cl- |
B.pH=1的溶液:Na+、K+、SO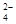 、CO 、CO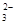 |
C.含有大量Fe3+的溶液:Na+、Mg2+、NO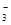 、SCN- 、SCN- |
D.含有大量NO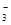 的溶液:H+、Fe2+、SO 的溶液:H+、Fe2+、SO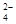 、Cl- 、Cl- |
某镁铝合金中,镁与铝物质的量之比为1:1,将两份质量相等的镁铝合金分别与足量的盐酸、NaOH溶液反应,生成气体的物质的量之比为
| A.5:3 | B.1:2 | C.3:5 | D.2:3 |
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
| A.X、M两种元素只能形成X2M型化合物 |
| B.由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
C.元素Y、Z、W的单质晶体 属于同种类型的晶体 属于同种类型的晶体 |
| D.元素W和M的某些单质可作为水处理中的消毒剂 |
可以验证硫元素的非金属性比氯元素弱的 事实是
事实是
①H2S水溶液是弱酸,HCl水溶液是强酸②向氢硫酸溶液中滴入氯水有单质硫生成
③硫、氯气分别与铜和铁反应,其产物是FeS、Cu2S、FeCl3、CuCl2
④高氯酸(HClO4)的酸性比硫酸强
| A.①②④ | B.②④ | C.②③④ |
D.①②③④ |
设NA为阿伏加德罗常数的值,下列叙述不正确的是
| A.36g镁在足量的氮气中完全燃烧共转移的电子数为3NA |
| B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳氢键数目为3NA |
| C.标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA |
| D.1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |