有三个热化学方程式:① 2H2 (g) + O2 (g) = 2H2O (g) ;ΔH1= Q1 kJ/mol;② 2 H2 (g) + O2 (g) =" 2" H2O (l) ;ΔH2 =Q2 kJ/mol;③ H2 (g) + 1/2 O2 (g) = H2O (g) ;ΔH3= Q3 kJ/mol;其中Q1、Q2、Q3的大小关系为
| A.Q1 = Q2 = Q3 | B.2Q3 = Q1 < Q2、 |
| C.Q3 < Q2 < Q1 | D.Q2< Q1< Q3 |
分析发现,某陨石中含有一种半衰期极短的放射性原子—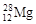 ,下列关于该原子的说法正确的是()
,下列关于该原子的说法正确的是()
| A.该原子核内中子数是12 |
B.它和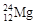 互为同位素 互为同位素 |
C.它和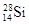 互为同位素 互为同位素 |
D.该原子极不稳定,与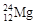 的化学性质有很大差异 的化学性质有很大差异 |
下列叙述中肯定A金属性比B金属性强的是( )
| A.A原子的最外层电子数比B原子的最外层电子数少 |
| B.A原子的电子层数比B原子的电子层数多 |
| C.1 mol A与足量酸反应生成的H2比1 mol B与足量酸反应生成的H2多 |
| D.常温时,A能从水中置换出氢,而B不能 |
运用元素周期律分析下面的推断,其中推断错误的是( )
| A.氢氧化铍[Be(OH)2]的碱性比氢氧化镁弱 |
| B.砹(At)为有色固体,HAt不稳定 |
| C.硫酸锶(SrSO4)是难溶于水的白色固体 |
| D.硒化氢(H2Se)是无色、有毒,比H2S稳定的气体 |
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:r(A)>r(B)>r(D)>r(C)
B.原子序数:d>c>b>a
C.离子半径:r(C3-)>r(D-)>r(B+)>r(A2+)
D.单质的还原性:A>B>D>C
下列说法正确的是( )
A.金属元素不能得电子,不显负价,故金属元素不能形成阴离子
B.P、S、Cl元素最高正价依次升高
C.B、C、N、O、F原子半径依次增大
D.Li、Na、K、Rb的氧化物对应水化物的碱性依次减弱