已知A(g)+B(g)  C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。
C(g) +D(g) 反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是_______反应(填“吸热”、“放热”)。当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),
(2)在反应体系中加入催化剂,反应速率增大,E的变化是_________,(填“增大”、“减小”或“不变”) E的大小对该反应的反应热有无影响? 。
下列物质的转化或分离是用哪种方法实现的?
| A.溶解 | B.裂解 | C.分馏 | D.裂化 E.干馏 |
F.蒸馏 G.电解 H.过滤 I.萃取
请将所选方法的字母代号填在横线上(每一项只填写一种最主要的方法)。
(1)把煤转化为焦炉气、煤焦油和焦炭等
(2)从原油中分离出汽油、煤油、柴油等
(3)将海水淡化
(4)除去粗盐溶液中的泥沙
(5)从海水得到的无水MgCl2中提取金属镁
(6)海水提溴获得的溴水中,提取溴单质
共12分) 下图中,A为芳香化合物,苯环上有两个邻位取代基: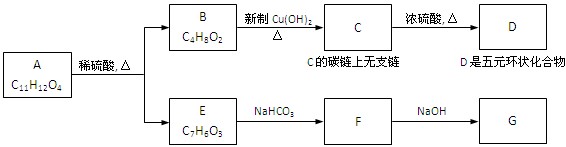
请回答:
(1)、B所含的官能团的名称是
(2)、反应C→D的化学方程式是
反应类型是
(3)、A的结构简式是、E的结构简式是
(4)、C在一定条件下可生成一种高分子化合物H,请写出C→H的化学方程式:
。
(5)、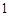 mol G的溶液可跟mo1CO2反应
mol G的溶液可跟mo1CO2反应
(6)、B有多种同分异构体,写出属于酯类且能发生银镜反应的同分异构体的结构简式
。
(共8分) 有机物A为绿色荧光蛋白在一定条件下水解的最终产物之一,结构简式为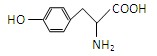
请回答下列问题:
(1)、关于A的性质推断错误的是 ;
a.A既能和酸反应又能和碱反应 b.A不能发生加成反应
c.A可以发生氧化反应 d.A不能通过缩聚反应得到高分子化合物
(2)、A与氢氧化钠溶液反应的化学方程式为 ;
(3)、符合下列4个条件A的同分异构体有 种;
① 1,3,5-三取代苯; ② 遇氢氧化铁溶液显紫色;
③ 氨基与苯环直接相连; ④ 属于酯类
(4)、写出符合上述题意的任意一种A的同分异构体的结构简式。
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: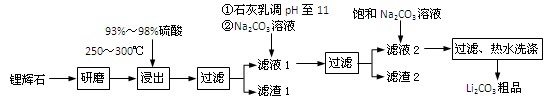
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓)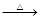 Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ |
20 |
40 |
60 |
80 |
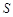 (Li2CO3)/g (Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
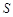 (Li2SO4)/g (Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
③ 从滤渣1中分离出Al2O3的部分流程如下图所示:
(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。
(共10分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用焦炭与水蒸气在高温下的反应产物(水煤气)合成二甲醚。请回答下列问题:
(1)、制水煤气的主要化学反应方程式为: 。
(2)、煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为: 。
(3)、利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)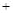 CO(g)
CO(g) CH3OH(g)
CH3OH(g)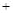 90.8 kJ
90.8 kJ
② 2CH3OH(g) CH3OCH3(g)
CH3OCH3(g)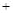 H2O(g)
H2O(g)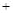 23.5 kJ
23.5 kJ
③ CO(g)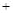 H2O(g)
H2O(g) CO2(g)
CO2(g)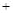 H2(g)
H2(g)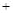 41.3 kJ
41.3 kJ
总反应:3H2(g)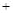 3CO(g)
3CO(g) CH3OCH3(g)
CH3OCH3(g)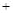 CO2(g)
CO2(g)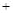 Q,其中Q
Q,其中Q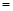 kJ;
kJ;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是
(填字母代号)。
a.低温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度
(4)、已知某温度下反应②2CH3OH(g) CH3OCH3(g)
CH3OCH3(g)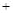 H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
H2O(g)在一密闭容器中进行到10min时恰好达平衡,测得各组分的浓度如下:
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
浓度/(mol·L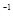 ) ) |
0.44 |
0.6 |
0.6 |
比较此时正、逆反应速率数值(单位相同)的大小: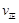 (甲醇)
(甲醇) 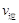 (水)(填“>”、“<”或“=”)。
(水)(填“>”、“<”或“=”)。
反应开始时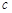 (CH3OH)
(CH3OH)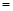 ;
;
该时间内的平均反应速率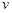 (CH3OH)
(CH3OH)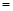 ;
;
该温度下反应的平衡常数值为 。(精确到0.01)