常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。回答下列问题:
(1)写出MOH在水溶液中的电离方程式
(2)MOH与HA恰好完全反应时,溶液呈_____性(填“酸”、“碱”或“中”),理由是(用离子方程式表示)__ _____;此时,混合溶液中由水电离出的c(H+)__ _ 0.2 mol/L HA溶液中由水电离出的c(H+)(填“>”“<”或“=”)。
(3)写出B点混合溶液中各离子浓度的大小关系_________ _;
(4)D点时,溶液中c(A-)+c(HA)________2 c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH = 3,则 c(HA) + c(H+) = __________mol/L(数字表达式,不必具体算出结果)
某实验活动小组在实验室进行中和 反应反应热的测定。请回答下列问题:
反应反应热的测定。请回答下列问题:
(1)测定中和反应反应热的实验装置如图所示。在两个烧杯之间填弃碎泡沫塑料的目的是。
(2)在进行中和反应反应热的测定中,量取50 mL 0.50mol/L的盐酸,倒入小烧杯中,测量盐酸的温度,然后需加入下列试剂(填序号)
①50mL 0.50mol/L NaOH溶液
②50mL 0.55mol/L NaOH溶液
③1.0g NaOH固体
(3)下述情况会使中和反应反应热的测定结果偏小的是(填序号)
a.用量筒量取50mL 0.50mol/L的盐酸时仰视读数
b.分多次把(2)中所选试剂倒入盛有盐酸的小烧杯中
c.用醋酸代替盐酸
在密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇: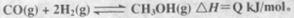 CO的转化率与温度、压强的关系如图所示。
CO的转化率与温度、压强的关系如图所示。

(1)若A、B两点表示在某时刻达到的平衡状态。将混合气体加热至200℃,自反应开始达到平衡状态A点所需要的时间为a min,容器体积为b L。反应达A点时此过程的反应速率为v(CO)=mol/(L·min),则该温度下的平衡常数KA=。B点时容器的体积VB=b L (填“>”、“<”或“=”)。此反应的反应热
△H=0(填“>” 或“<”)
或“<”)
(2)若A、C两点分别表示某温度、压强下达到的平衡状态。则自反应开始达到平衡状态所需要的时间tAtC(填“>”、“<”或“=”)
(3)在不改变反应物用量情况下,为提高CO转化率可采取的措施是(写出一种方法即可)
A、B、C、D、E、F六种物质在一定条件下有如图所示相互转化关系,所有反应物和生物均已给出。
(1)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D、E的循环,反应③是呼吸面具中发生的反应。则A的化学式为,F的化学式为,反应①的离子方程式为。
(2)若D能使淀粉溶液变为蓝色,B的焰色反应为黄色,反应①、②、③均为溶液中的置换反应,A、D、E为卤素单质。则A、D、E的氧化 性由强到弱的顺序为(用序号表示),其中A的化学式是;反应②的化学方程式为。写出工业上获得E的化学方程式。
性由强到弱的顺序为(用序号表示),其中A的化学式是;反应②的化学方程式为。写出工业上获得E的化学方程式。
已知X、Y、Z、W为四种短周期元素,其原子序数依次增大,且由这些元素所组成的单质在常温下均呈气态。X、Y、W处于不同 周期,且在一定条件下其单质能发生反应:
周期,且在一定条件下其单质能发生反应: 甲、乙可化合生成离子化合物丙。试回答下列问题:
甲、乙可化合生成离子化合物丙。试回答下列问题:
(1)W元素在周期表中的位置是周期、族;Y2的电子式是。
(2)X、Y、Z原子半径由大到小顺序为(写元素符号);丙的水溶液呈酸性,用离子方程式表示其原因。
(3)X、Z可组成四原子化合物丁,其化学式为,此分子中含有的共价键类型为 。
(4)X、Y组成的液态化合物Y2X416g与足量的丁反应生成Y2和液态水,放出QkJ(Q>0)的热量,请写出该反应的热化学方程式;Y2X4还可以和Z2构成清洁高效的燃料电池,若电解质溶液为NaOH溶液,则负极的电极反应式为。
合金已成为飞机制造、化工生产等行业的 重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
重要材料。研究性学习小组的同学,为测定某含镁3%~5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
〖实验方案一〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。实验中发生反应的化学方程式是 。
〖实验步骤〗
(1)称取5.4 g铝镁合金粉末样品,溶于V mL 2.0 moI·L-1NaOH溶液中,充分反应。则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”、“偏低”或“无影响”)。
〖实验方案二〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积。
〖问题讨论〗(3)同学们拟选用下列实验装置完成 实验:
实验: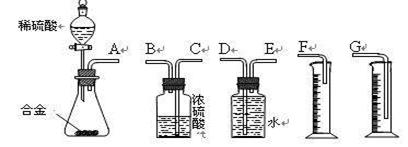
①你认为最简易的装置其连接顺序是(填接口字母,可不填满):
A接( )( )接( )( )接( )
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是 。
| A.待实验装置冷却后再读数 |
B.上下移动量筒F,使其中液面与广口瓶中液面相平 |
C.上下移动量筒G,使其中液面与广口瓶中液面 相平 相平 |
D.视线与 凹液面的最低点水平,读取量筒中水的体积 凹液面的最低点水平,读取量筒中水的体积 |