下列有关“电离平衡”的叙述中正确的是( )。
| A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 |
| B.达到电离平衡时,由于分子和离子的浓度不再发生变化,所以说电离平衡是静态平衡 |
| C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动 |
| D.电解质达到电离平衡后,各种离子的浓度相等 |
常温下,对pH=10的NaHCO3溶液中,各微粒的物质的量浓度分析正确的是
| A.c(CO32-)>c(H2CO3) |
| B.c(Na+)>c(HCO3-)>c(H+)>c(OH-) |
| C.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
下列溶液一定呈酸性的是
| A.pH<7的溶液 | B.c(H+)>c(OH-) 的溶液 |
| C.pH>7的溶液 | D.c(H+)<c(OH-) 的溶液 |
99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是
| A.此时水的离子积Kw=1×10-12 | B.水电离出的c(H+)=1×10-12 mol/L |
| C.水的电离程度随温度升高而增大 | D.c(Na+)=c(SO42-) |
常温下,将pH和体积都相同的盐酸和醋酸溶液分别加蒸馏水稀释,pH随溶液体积变化如图,下列有关叙述正确的是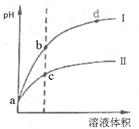
| A.曲线I为醋酸稀释时pH值变化曲线 |
| B.a点时,若都加入相同大小的锌粒,此时盐酸反应的速率大 |
| C.a点时,若都加入足量的锌粒,最终与醋酸反应产生的氢气多 |
| D.b点溶液中水的电离程度比c点溶液中水的电离程度小 |
相同容积的四个密闭容器中进行同样的可逆反应:2X(g)+Y(g) 3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol)乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol)丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
3W(g)+2Z(g)起始时四个容器所装X、Y的量分别为:甲(X:2mol,Y:1mol)乙(X:1mol,Y:1mol)丙(X:2mol,Y:2mol)丁(X:1mol,Y:2mol)在相同温度下,建立平衡时,X或Y的转化率大小关系为
| A.X的转化率为:甲<丙<乙<丁 |
| B.X的转化率为:甲<乙<丙<丁 |
| C.Y的转化率为:甲>丙>乙>丁 |
| D.Y的转化率为:丁>乙>丙>甲 |