反应2SO2+O2 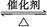 2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )。
2SO3经一段时间后,SO3的浓度增加了0.8 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为( )。
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
一定条件下,达到平衡状态时的可逆反应2A(g) 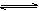 2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是( )
2B(g)+C(g)(正反应为吸热反应),要使B的物质的量增大,而正反应速率降低,可采取的措施是( )
| A.增加A的物质的量 | B.减小A的物质的量 |
| C.升高体系的温度 | D.减小体系的压强 |
某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g);ΔH<0。下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( ) 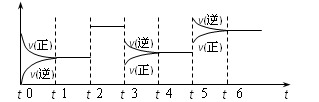
| A.t5时增大了压强 | B.t3时降低了温度 |
| C.t2时加入了催化剂 | D.t4~t5时间内转化率一定最低 |
改变反应条件使化学平衡向正反应方向移动时,下列变化中正确的是()
| A.生成物浓度一定增大 | B.生成物的物质的量分数一定增大 |
| C.反应物的转化率一定增大 | D.某生成物的产率可能提高 |
下列关于反应能量的说法正确的是()
| A.101kPa时,2H2(g)+O2(g)=2H2O(l) ΔH="-571.6" kJ/mol,H2的燃烧热为571.6 kJ·mol- |
| B.Zn(s)+CuSO4(aq)=ZnSO4 (aq)+Cu(s) ΔH="-216" kJ·mol-,反应物总能量>生成物总能量 |
| C.H+(aq)+OH-(aq)=H2O ΔH="-57.3" kJ·mol-,含1molNaOH的氢氧化钠的溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量。 |
| D.相同条件下,如果1molH所具有的能量为E1,1molH2所具有的能量为E2,则2 E1= E2 |
可逆反应2NO2 2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是
2NO+O2在恒容密闭容器中反应,可以作为达到平衡状态的标志是
①单位时间内生成n mo1 O2的同时生成2nmol NO2
②单位时间内生成nmol O2的同时生成2nmolNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
| A.①③⑤ | B.②④⑤ | C.①③④ | D.①②③④⑤ |