将1mol SO2和1mol O2通入一个固定容积的密闭容器中,在一定温度下反应达到平衡,平衡体系中有SO3 0.3mol,此时若移走0.5mol O2和0.5 mol SO2,则反应达到新平衡时SO3的物质的量为( )
| A.0.3mol | B. 0.15mol |
| C.小于0.15mol | D.大于0.15mol,小于0.3mol |
下各各微粒半径依次增加的是()
| A.Cs+、K+、Mg+、Al3+ | B.F、F―、Cl―、Br― |
| C.Ca2+、K+、Cl―、O2― | D.Al、Al3+、Mg、K |
下图是周期表中短周期的一部分,已知Y原子与Z原子核外电子总数为X原子核外电子数的4倍,以下推断正确的是()
| A.X、Y、Z三者均为金属元素 |
| B.X、Y、Z三者核外电子数之和为40 |
| C.X与Y、Y与Z均可形成离子化合物 |
| D.Y与Z只能形成一种共价化合物 |
已知A、B是第一周期以外的短周期元素,它们可以形成离子化合物AmBn,在此化合物中,所有离子均能形成稀有气体原子的稳定结构。若A的核电数为a,则B的核电荷数不可能为()
A.a+8-m-n. B.a+18―m―n C.a+16―m―n D.a―m―n
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是()
| A.固体碘的升华 | B.生右灰作为干燥剂吸水 |
| C.氯化钠的熔化 | D.酒精溶解于水 |
下列用电子式表示物质的形成过程中正确的是()
A.Na·+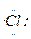 →[Na]+[ →[Na]+[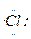 ]- ]- |
B.  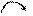  |
C.Na·+ +·Na→Na+[ +·Na→Na+[ ]2-Na+ ]2-Na+ |
D. |