欲探究氯气与碘单质的氧化性强弱,某同学设计了如下装置(用浓盐酸和KMnO4固体反应制取氯气)。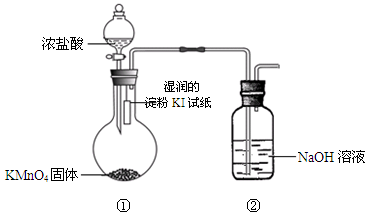
请回答:
(1)实验中观察到湿润的淀粉KI试纸 ,写出其中发生的置换反应的离子方程式: 。
(2)实验结论:氯单质的非金属性比碘单质的 (填“强”或“弱”)。从原子结构角度解释:氯和碘位于周期表中 族,该族元素从上到下, ,得电子能力减弱。
(3)装置②的作用是 。
写出相应的化学方程式:
下列各表述与示意图不一致的是
(1)图①表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的物质的量和NaOH的体积的关系图。则三种离子的物质的量之比为______________________;
图②中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C时,△H____0,若使用正催化剂,E值会_____________(增大、减小、不变)。
(2)在Cu2O/ZnO做催化剂的条件下,将CO(g)和H2O(g)充入容积为2L的密闭容器中合成CH3OH(g) ,反应过程中,CH3OH的物质的量(n)与时间(t)及温度的关系如图.根据题意回答下列问题:
①反应达到平衡时,平衡常数表达式K=______________;升高温度,K值____________(填“增大”、“减小”或“不变”).
②在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= ____________;
③若其它条件不变,对处于Z点的体系,将体积压缩至原来的 1/2,达到新的平衡后,下列有关该体系的说法正确的是_________;
a.氢气的浓度与原平衡比减少 b.正、逆反应速率都加快
c.甲醇的物质的量增加d.重新平衡时n(H2) /n(CH3OH)增大
④据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2有利于维持Cu2O的量不变,原因是_________________;(写出相关的化学方程式并辅以必要的文字说明).
Ⅰ在右图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极。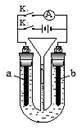
①断开K2接通K1时,为_____________极,b电极上的电极反应式为________________;
②断开K1时接通K2,a为_____________极;该电极上的电极反应式是____________一段时间后,溶液的pH_________(填“增大”、“减小”或“不变”)
Ⅱ、双隔膜电解池的结构示意简图如图所示,利用该装置可以电解硫酸钠溶液以制取硫酸和氢氧化钠,并得到氢气和氧气。
a气体为______________,B溶液为________________;C隔膜为____________(阳离子交换膜、阴离子交换膜),该电解反应的总方程式可表示为_______________________。
某有机物ag与0.8mol O2在密闭容器中充分混合后点燃。待充分反应后,将产物中的H2O(g)和其它气态产物先缓慢通过足量澄清石灰水,产生40g白色沉淀,溶液质量减少0.8g。余下气体通过浓硫酸干燥后,再缓慢通过足量灼热CuO,固体由黑变红。将产生的气体又缓慢通过足量过氧化钠,充分反应后固体质量增加11.2g且只有氧气放出(假设每一步都充分反应或吸收)。请回答下列问题:
①通过计算确定该有机物化学式为 。
②若ag该有机物恰好与18.4g金属钠完全反应,试确定该有机物的结构简式 。
③若0.4mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式 。
(已知① 醚不与钠反应 ②一个碳原子上同时连2个或多个羟基是不稳定的)
下面几组物质,请将合适组号填写在下表中。
① 和
和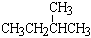 ;②
;② 和
和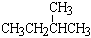 ;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
;③CH4和CH3CH2CH3;④金刚石与石墨;⑤氕、氘与氚;⑥16O、17O和18O;⑦乙醇(CH3CH2OH)和二甲醚(CH3OCH3);⑧氧气(O2)与臭氧(O3)。
| 类别 |
同位素 |
同系物 |
同素异形体 |
同分异构体 |
| 组号 |
(1)回答下列问题:
① CH2=CH-CH=CH2 键线式__________;
② 的结构简式___________
的结构简式___________
③芳香烃萘 的分子式为
的分子式为
(2)写出下列有机物的系统命名或结构简式(6分):
①2,2-二甲基-3-乙基己烷 ;
②CH3CH(CH3)C(CH3)2CH2CH3 ;
③ 。
。