在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计下列实验图以确认上述混合气体中有C2H4和SO2。回答下列问题: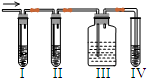
(1)实验室制备乙烯的反应方程式是:
(2)I、II、III、IV装置可盛放的试剂是I ;II ;III ;IV 。(将下列有关试剂的序号填入空格内)。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性KMnO4溶液 |
(3)能说明SO2气体存在的现象是 。(4)使用装置II的目的是 。
(5)使用装置III的目的是 。(6)确定含有乙烯的现象是 。
碘被称为"智力元素",科学合理地补充碘可防止碘缺乏病。碘酸钾(
)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。请回答下列问题:
(1)碘是(填颜色)固体物质,实验室常用方法来分离提纯含有少量杂 质的固体碘。
质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为;阴极上观察到的实验现象是。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有
。请设计一个检验电解液中是否有
的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
步骤②的操作名称是,步骤⑤的操作名称是。步骤④洗涤晶体的目的是.
某化学兴趣小组为探究
的性质,按下图所示装置进行实验。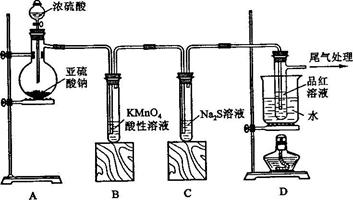
请到答
列问题:
(1)装置
中盛放亚硫酸钠的仪器名称是,其中发生反 应的化学方程式为;
应的化学方程式为;
(2)实验过程中,装置
、
中发生的现象分别是、,这些现象分别说明
具有的性质是和;装置B中发生反应的离子方程式为;
(3)装置
的目的是探究
与品红作用的可逆性,请写出实验操作及象;
(4)尾气可采用 溶液吸收。
溶液吸收。
聚合硫酸铁又称聚铁,化学式
,广泛用于汗水处理,实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量
、
等)制备聚铁和绿矾(
),过程如下:
(1)验证固体
焙烧后产生的气体含有
的方法是。
(2)实验室制备,收集干燥的
,所需仪器如下。装置A产生
,按气流方向链接各仪器口,顺序为
→→→→→
。装置
的作用是,装置
中
溶液的作用是。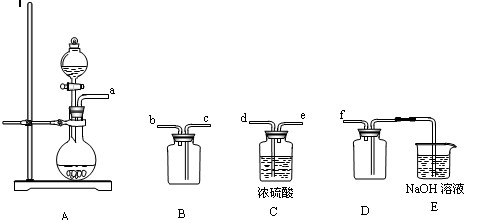
(3)制备绿矾时,向溶液
中加入过量,充分反应后,经操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液
的
影响聚铁中铁的质量分数,用
试纸测定溶液
的操作方法为。若溶液
的
偏小,将导致聚铁中铁的质量分数偏。
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除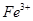 外还可能含有
外还可能含有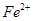 。若要确认其中的
。若要确认其中的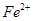 ,应先用 选填序号)。
,应先用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性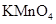 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应: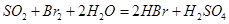
然后加入足量 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中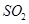 的体积分数为 。
的体积分数为 。
[探究二]
分析上述实验中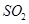 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有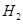 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有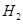 ,预计实验现象应是 。
,预计实验现象应是 。
(7)若要测定限定体积气体Y中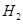 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml 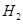 ),除可用测量
),除可用测量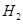 体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
工业生产纯碱的工艺流程示意图如下: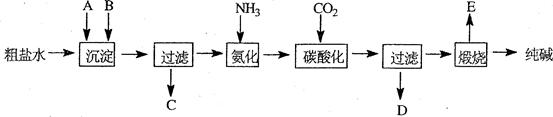
完成下列填空:
1)粗盐水加入沉淀剂
、
除杂质(沉淀剂
来源于石灰窑厂),写出
、
的化学式。
2)实验室提纯粗盐的实验操作依次为:
取样、、沉淀、、、冷却结晶、、烘干。
3)工业生产纯碱工艺流程中,碳酸化时产生的现象是。
碳酸化时没有析出碳酸钠晶体,其原因是。
4)碳酸化后过滤,滤液D最主要的成分是(填写化学式),检验这一成分的阴离子的具体方法是:。
5)氨碱法流程中氨是循环使用的,为此,滤液
加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:
滤液
加石灰水前先要加热,原因是。
6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:(注明你的表达式中所用的有关符号的含义)