胶体区别于其它分散系的本质是( )
| A.胶体分散质粒子直径在1 nm~100nm之间 | B.具有丁达尔现象 |
| C.胶体粒子不能穿过半透膜,能通过滤纸空隙 | D.胶体粒子在一定条件下能稳定存在 |
下列离子方程式书写正确的是()
| A.将Na投入CH3COOH中:2Na+2H+=2Na++H2↑ |
B.将过量氨水加入到AlCl3溶液中:Al3++4OH-= +2H2O +2H2O |
| C.向氯化银悬浊液中加入溴化钾溶液:Ag++Br-=AgBr↓ |
D.碳酸氢钙溶液中加入等物质的量的氢氧化钠溶液:Ca2++ 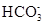 + OH-= CaCO3↓+H2O + OH-= CaCO3↓+H2O |
下列反应的离子方程式书写正确的是()
A.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=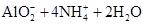 |
| B.氧化钠与水反应:O2-+H2O=2OH- |
| C.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O |
| D.氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
常温下,下列各组离子在指定溶液中一定能大量共存的是()
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、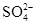 |
B.甲基橙呈红色的溶液: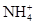 、Ba2+、 、Ba2+、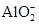 、Cl- 、Cl- |
| C.pH=12的溶液:K+、Na+、CH3COO-、Br- |
D.与铝反应产生大量氢气的溶液:Na+、K+、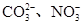 |
铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应反应的离子方程式书写正确的是()
A.OH-+HCl=H2O+Cl-B.Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C.Fe+Cu2+=Cu+Fe2+D.Fe+2H+=Fe3++H2↑
下列说法正确的一组是()
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②盐都是强电解质
③0.5 mol·L-1的所有一元酸中氢离子浓度都是0.5 mol·L-1
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤电解质溶液导电的原因是溶液中有自由移动的阴、阳离子
⑥熔融的电解质都能导电
| A.①③⑤⑥ | B.②④⑤⑥ | C.只有⑤ | D.只有⑥ |