某溶液中含有HCO3-、SO32-、SO42-、Cl-和Na+,若向其中通入Cl2,溶液中离子浓度增大的是
| A.HCO3- | B.SO42- | C.SO32- | D.OH- |
气体的体积主要由以下什么因素决定的:①气体分子的直径 ②气体物质的量的多少 ③气体分子间的平均距离 ④气体分子的相对分子质量 ()
| A.①② | B.①③ | C.②③ | D.②④ |
19世纪初,某科学家提出了原子学说,他认为物质由原子组成,原子不能被创造,也不能被毁灭,在化学反应中不能再分,这个科学家是 ()
| A.汤姆生 | B.道尔顿 | C.卢瑟福 | D.波尔 |
同温同压下,等质量的下列气体 所占有的体积最大的是
所占有的体积最大的是
| A.O2 | B.CH4 | C.CO2 | D.SO2 |
三种正盐的混合溶液中含有0.2mol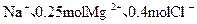 ,则
,则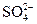 的物质的量为:
的物质的量为:
| A.0.1 mol | B.0.3 mol | C.0.5 mol | D.0.15 mol |
从1 L 1 mol/LNaOH溶液中取出100 ml,下列关于这100 ml溶液的叙述中错误的是
| A.含NaOH 0.1 mol | B.浓度为1 mol/L |
| C.含NaOH 4g | D.浓度为0.1 mol/L |