某同学写出下列烷烃的名称中,不正确的是
| A.2,3—二甲基丁烷 | B.3,3—二甲基戊烷 |
| C.2,2,3,3—四甲基丁烷 | D.3—甲基—2—乙基戊烷 |
某合作学习小组讨论辨析:①漂白粉和酸雨都是混合物②煤和石油都是可再生能源③不锈钢和目前流通的硬币都是合金④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物⑤蛋白质溶液、淀粉溶液和雾都是胶体。上述说法正确的是
| A.①③⑤ | B.①②④ | C.②③④ | D.③④⑤ |
下列做法不能体现低碳生活的是
| A.减少食物加工过程 | B.大量使用薪柴为燃料 |
| C.尽量购买本地的、当季的食物 | D.注意节约用电 |
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为(已知Ba(AlO2):可溶)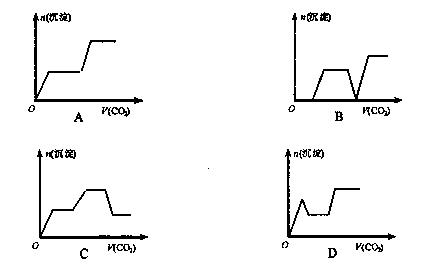
工业上生产Mn02和Zn的主要反应有:
①MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O
②MnSO4+ZnSO4+2H2O
下列说法不正确的是()
| A.①中MnO2和H2SO4都是氧化剂 | B.①中析出16 g S时转移l mol电子 |
| C.②中MnSO4发生氧化反应 | D.硫酸在该生产中可循环利用 |
将51.2gCu完全溶于适量浓硝酸中,在标况下收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共17.92 L,这些气体恰好能被400 mL 2.5 mol/LNaOH溶液完全吸收,溶液中生成NaNO3和。NaNO2,则原混合气体中NO的物质的量为()
| A.0.3 mol | B.0.4 mol | C.0.5 mol | D.0.6 mol |