2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是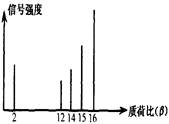
| A.甲醇 | B.甲烷 | C.丙烷 | D.乙烯 |
取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水,原混合物中氧元素的质量是
| A.6.4g | B.3.2g | C.1.6g | D.0.8g |
下列装置或操作与实验目的最相符的是
| A.①——实验室制取并收集足量NH3 |
| B.②——以溴化钾、90%硫酸、乙醇为原料合成溴乙烷的装置 |
| C.③——检查装置气密性 |
| D.④——利用排空气法收集CO2 |
“封管试验”具有简易、方便、节约、绿色等优点。观察下列四个“封管试验”(夹持装置未画出),判断下列说法正确的是
| A.加热时,a上部聚集了固体NH4Cl,说明NH4C1的热稳性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.水浴时,d内气体颜色变浅,e内气体颜色加深 |
下列叙述不正确的是
| A.铜锌稀硫酸原电池工作时,电子沿外电路从铜电极流向锌电极 |
| B.船底镶嵌锌块,锌作负极,以防船体被腐蚀 |
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e 4OH- 4OH- |
D.工业上电解饱和食盐水的阳极反麻:2Cl-- 2e C12↑ C12↑ |
三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3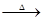 3HNCO;8HNCO+6NO2
3HNCO;8HNCO+6NO2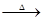 7N2+8CO+4H2O。
7N2+8CO+4H2O。
下列说法止确的是
| A.C3N3(OH)3与HNCO为同一物质 | B.1mol HNCO与NO2反应时转移3mol电子 |
| C.HNCO是强氧化剂 | D.反应中CO2是氧化产物 |