煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH=+131.3 kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与 有很大关系;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)。
a.容器中的压强不变 b.1 mol H—H键断裂的同时断裂2 molH—O键
c.v正(CO) = v逆(H2O) d.c(CO)=c(H2)
(2)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生如下反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ,
CH3OH(g)+H2O(g) ,
右图表示该反应进行过程中能量(单位为kJ•mol-1)的变化。
在体积为1 L的恒容密闭容器中,充入1mol CO2和3mol H2,
下列措施中能使c (CH3OH)增大的是 。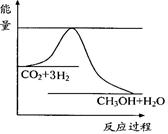
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1mol CO2和3mol H2
将等物质的量A、B气体,置于容积为2L的密闭容器中发生反应,当反应进行到8s末,达到该反应的限度,测得A的物质的量减少0.6mol,B的物质的量减少0.2mol,C的物质的量增加0.4mol,此时n(A):n(B):n(C)=1:2:1。
则:
(1)该反应的化学方程式为:;
(2)用生成物C表示的该反应的速率为:;
(3)反应前A、B的物质的量浓度是:。

(1)已知 A、B、C、D是中学化学中常见的四种不同
A、B、C、D是中学化学中常见的四种不同 微粒,它们之间存在如图所示的转化关系.如果A、B是
微粒,它们之间存在如图所示的转化关系.如果A、B是 10电子离子,C、D是10电子分子,A、B、C、D均含有
10电子离子,C、D是10电子分子,A、B、C、D均含有 两种元素.请写出A、B、C、D四种不同微粒的化学式:
两种元素.请写出A、B、C、D四种不同微粒的化学式: A、B、
A、B、 C、D.
C、D.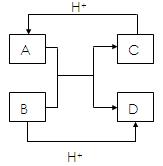
(2)现有如下两个反应:(A)NaOH + HCl =" NaCl" + H2O(B)Zn + CuCl2 = ZnCl2+ Cu
①根据两反应本质,判断能否设计成原电池(A)(B)
②如果能,实验结束后,称得两极质量差为12.9g,则转移电子的物质的量为__________.
③如果不能,说明其原因
(9分)下表为元素周期表的一部分,请回答有关问题:
| IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)
(2) 最高价氧化物对应水化物酸性最强的化合物是__________;(填写分子化学式)
(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子反应方程式:
_____________________,___________________________;
(4)比较⑦、⑩单质氧化性的强弱:__________________________。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和B 原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C在空气中燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1)元素名称: A ______ B _____ C _____ D ______。
(2)D元素位于周期表中周期族。
(3)写出AB2与C2B2反应的化学方程式。
(4)画出B的原子结构简图 ___________________。
(5)电子式表示化合物 C2D:。
用“大于”或“小于”或“等于”回答下列问题:
(1)酸性:H2CO3H2SiO3, H2SiO3H3PO4
(2)碱性:Ca(OH)2Mg(OH)2, Mg(OH)2Al(OH)3
(3)气态氢化物稳定性:H2OH2S, H2SHCl
(4)还原性: H2OH2S, H2SHCl
(5)酸性: H2SO4H2SO3, HClO4HClO
从以上答案中可以归纳出:
①元素的非金属性越强,其对应最高价氧化物水化物的酸性越;
②元素的金属性越强,其对应最高价氧化物水化物的碱性越。