在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸(以下填空分别用a、b、c表示)
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是 。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是 。
(3) 将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是 。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 。
(5)当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,则开始时反应速率的大小关系为 。
11 mol丙酮酸 在镍催化剂作用下加1 mol氢气转化变成乳酸。乳酸的结构简式为_________________________________________。
在镍催化剂作用下加1 mol氢气转化变成乳酸。乳酸的结构简式为_________________________________________。
2与乳酸具有相同官能团的乳酸的同分异构体A在酸性条件下,加热失水生成B,由A生成B的化学反应方程式是_________________________________
3B的甲酯可以聚合,聚合物的结构简式是 。
人造羊毛的主要成分为 ,此物质可由以下三种途径合成,已知A是石油分馏的一种产品。
,此物质可由以下三种途径合成,已知A是石油分馏的一种产品。
回答下列问题:
1写出A的分子式________________,D的结构简式__________________
2在反应①~⑥中,属于加成反应的是
3写出反应⑥的化学方程式:_____________________________________
4从能源和环保的角度看,你认为最有发展前景的是 ,其中理由是____________________________________________________
常用作风信子等香精的定香剂D以及可用作安全玻璃夹层的高分子化合物PVB的合成路线如下:
已知:Ⅰ.RCHO+R′CH2CHO
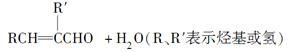
Ⅱ.醛与二元醇(如:乙二醇)可生成环状缩醛:
(1)A的核磁共振氢谱有两种峰。A的名称是_______________________。
(2)A与 合成B的化学方程式是____________________。
合成B的化学方程式是____________________。
(3)C为反式结构,由B还原得到。C的结构式是____________。
(4)E能使Br2的CCl4溶液褪色。N由A经反应①~③合成。
a.①的反应试剂和条件是________。
b.②的反应类型是________。
c.③的化学方程式是_____________________________________。
(5)PVAc由一种单体经加聚反应得到,该单体的结构简式是________。
(6)碱性条件下,PVAc完全水解的化学方程式是___________________。
根据图示回答下列问题: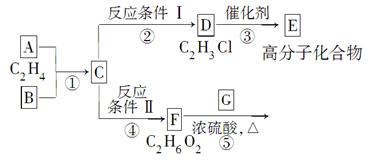

(1)写出A、E、G的结构简式:A:________,E______________________,G________;
(2)反应②的化学方程式(包括反应条件)是___________________;
反应④的化学方程式(包括反应条件)是___________________;
(3)写出①、⑤的反应类型:①________、⑤________。
(4)写出反应⑤的化学方程式:_________________________________。
化合物B是有机合成中间体,制取C4H4O4和E的转化关系如下图所示。已知C能使溴水褪色。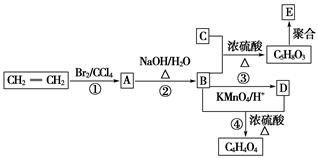
回答下列问题:
(1)指出反应类型:①________;②________。
(2)E的结构简式为:_____________________________________。
(3)写出②、④转化的化学方程式:
②__________________________________________________________;
④___________________________________________________。