(1)写出甲烷发生一氯取代反应的化学方程式
(2)写出苯和浓硝酸、浓硫酸混合液在50 ~ 60℃时发生反应的化学方程式
( 9分)对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含乙酸钠和对氯酚( )的废水可以通过构成微生物电池除去,其原理如下图所示。
)的废水可以通过构成微生物电池除去,其原理如下图所示。
①B是电池的极(填“正”或“负”);②A极的电极反应式为。
(2)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA ”表示乳酸分子,A-表示乳酸根离子)。
①阳极的电极反应式为;
②简述浓缩室中得到浓乳酸的原理;
③电解过程中,采取一定的措施可控制阳极室的pH约为6~8 ,此时进人浓缩室的OH-可忽略不计。400 mL10g/L 乳酸溶液通电一段时间后,浓度上升为 145g/L(溶液体积变化忽略不计),则阴极上产生的H2在标准状况下的体积约为L(乳酸的摩尔质量为90g/ mol )。
(8分)U、W、X、Y、Z都是短周期元素,且原子序数依次增大。其中U与W可形成三角锥形分子甲,U与X可形成常温下呈液态的分子乙,甲、乙均为10 电子分子;Y 元素原子的 K 层电子数与M层电子数相同;Z元素的单质、氧化物均为原子晶体。请回答下列问题:
(1) Z元素在周期表中的位置。
(2)X、Y、Z三种元素的原子半径由小到大的顺序是(用元素符号表示)。
(3)U与X形成的18电子化合物的电子式是。
(4) ZX2与NaOH溶液反应的化学方程式是。
(5)已知:① N2(g) + 3H2 (g)= 2NH3 (g)△H=-92.4kJ/mol
②2H2(g) + O2(g) = 2H2O(g)△H=-483.6kJ/mol
试写出氨气完全燃烧生成气态水的热化学方程式。
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
回答下列问题:
Ⅰ、(1)在一定条件下,SO2转化为SO3的化学反应为2SO2(g)+O2(g)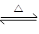 2SO3(g),该反应的平衡常数表达式为K=;过量的SO2与NaOH溶液反应的化学方程式为。
2SO3(g),该反应的平衡常数表达式为K=;过量的SO2与NaOH溶液反应的化学方程式为。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是、。
(3)通氯气氧化时,发生的主要反应的离子方程式为;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为(写化学式)。
Ⅱ、 已知: CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如图所示: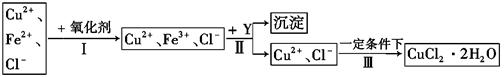
请回答下列问题:
(4)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的(填字母)。
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为。
(5)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的(填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(6)步骤Ⅲ应控制的实验条件是。
A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为主族元素的固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是。
(2)写出C、H物质的化学式:C,H。
(3)写出反应①、⑦的化学方程式:
反应①:;
反应⑦:。
(4)反应⑥过程中的现象是。
按要求完成下列各题。
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为:。
(2)ClO2常用子水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式:。
(3)MnO2可与KOH和KClO3在高温条件下反应,生成K2MnO4,反应的化学方程式为:。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为。
(4)(CN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为
。