在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
(1)2min内,平均反应速率v(SO3)=
(2)2min时,SO2的浓度为
现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L (标准状况)。
(1)则选用所贴标签为2.0mol·L-1的氢氧化钠,至少需该氢氧化钠多少毫升?
(2)如选用所贴标签为7%(密度为1.043g·mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸多少毫升?
已知某种燃料含有碳、氢、氧3种元素。为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全部通入如图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸收)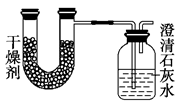
| 实验前 |
实验后 |
|
| (干燥剂+U形管)的质量 |
101.1 g |
102.9 g |
| (石灰水+广口瓶)的质量 |
312.0 g |
314.2 g |
根据实验数据求:
(1)实验完毕后,生成物中水质量为________g,假设广口瓶里生成一种正盐,其质量为________g;
(2)生成的水中氢元素的质量为________g;
(3)生成的二氧化碳中碳元素的质量为________g;
(4)该燃料中碳元素与氢元素的质量比为________;
(5)已知这种燃料的每个分子中含有一个氧原子,则该燃料的分子式为________,结构简式为________。
(1)乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,其中,与高锰酸钾发生的反应是________反应(填反应类型,下同);与溴发生的反应是________反应。在一定的条件下,乙烯还能发生________反应,生成聚乙烯。
(2)一种能使溴水褪色的气态烃,标准状况下5.6 L的质量为10.5 g,10.5 g该烃完全燃烧时生成16 .8 L二氧化碳和13.5 g水。则该烃的分子式为________。
(13分)通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是______________;
(2)X与金属钠反应放出氢气,反应的化学方程式是_____________________________
(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是____________;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。(要求写出计算过程)
(10分)由铜片、锌片和200 mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:
(1)反应中消耗的锌的质量是多少?
(2)有多少个电子通过了导线?
(3)原稀H2SO4的物质的量浓度是多少?