已知: 2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.519.4kJ·mol-1 | B.259.7 kJ·mol-1 | C.-259.7 kJ·mol-1 | D.-519.4kJ·mol-1 |
下列叙述正确的是
| A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵 |
| B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小 |
| C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变 |
| D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强 |
室温下,某溶液中由水电离出来的c(OH-)=10-12mol·L-1,则该溶液的溶质不可能是
| A.HCl | B.NaOH | C.NH4NO3 | D.H2SO4 |
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
| A.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 |
| C.MgO的熔点很高,可用于制作耐高温材料 |
| D.电解MgCl2饱和溶液,可制得金属镁 |
反应PCl5(g)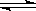 PCl 3(g)+Cl2(g) ①
PCl 3(g)+Cl2(g) ①
2HI(g)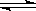 H2(g)+I2(g) ②
H2(g)+I2(g) ②
2NO2(g)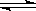 N2O4(g) ③
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
| A.均不变 | B.均增大 |
| C.①增大,②不变,③减少 | D.①减少,②不变,③增大 |
在一密闭容器中进行以下可逆反应:M(g)+N(g)
 P(g)+2L在不同的条件下P的百分含量P%的变化情况如下图,则该反应
P(g)+2L在不同的条件下P的百分含量P%的变化情况如下图,则该反应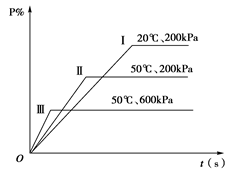
| A.正反应放热,L是固体 |
| B.正反应放热,L是气体 |
| C.正反应吸热,L是气体 |
| D.正反应放热,L是固体或气体 |