试回答下列问题:
(1) 标准状况下11.2L NH3中含____个氨分子, mol氢原子;
(2) 等质量的SO2和SO3所含的原子个数之比是 ,物质的量之比是 ;
(3)6.8gNH3中所含氢原子数与 g水所含氢原子数相等;
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g· mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体所含原子总数为_______个。
(3)该气体在标准状况下的体积为_________L。
(4)该气体溶于1L水中(不考虑反 应),其溶液中溶质的质量分数为______。
应),其溶液中溶质的质量分数为______。
将铜片投入盛有稀硫酸的试管中无反应。当加入少量硝酸钾晶体后,试管内产生一种无色气体,这种气体在试管口变成红棕色。这种无色气体是__________。写出有关的离子反应方程式.________________________________________________________
(3分)有 A、B、C三种短周期元素。A+只含有一个质子没有中子;B的正、负化合价绝对值相等,在同族元素中其氢化物最稳定;C的原子核内质子数是B的最外层电子数的3.5倍。试推断这三种元素分别是:A____,B____,C。(用元素符号表示)
有五种烃:甲烷、乙炔、苯和己烯(C6H12)、甲苯(C7H8).分别取一定质量的这些烃完全燃烧后生成的mmolCO2和nmol水.
(1)当m = n时,该烃是(2)当m ="2" n时,该烃是
(3)当2m = n时,该烃是(4)当4m = 7n时,该烃是
(6分)对于反应2SO2+O2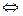 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
升高温度 |
|
| ② |
降低温度 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
|
| ⑤ |
压缩体积 |
|
| ⑥ |
恒容下充入Ne |