在pH=1的溶液中,可以大量共存的是:
| A.Na+、K+、S2-、Cl- | B.Al3+、Mg2+、SO42-、Cl- |
| C.Na+、K+、AlO2-、NO3- | D.Na+、K+、SO32-、SO42- |
在0.lmol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH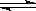 CH3COO-+H+对于该平衡,下列叙述正确的是()
CH3COO-+H+对于该平衡,下列叙述正确的是()
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.加水,反应速率加快,平衡向逆反应方向移动 |
| C.滴加少量0.lmol/L HCl溶液,溶液中[H+]减少 |
| D.加入少量CH3COONa固体,平衡向逆反应方向移动 |
汽车的启动电源常用铅蓄电池。放电时的电池反应如下:
PbO2 + Pb + 2H2SO4  2PbSO4↓+ 2H2O,根据此反应判断下列叙述中正确的()
2PbSO4↓+ 2H2O,根据此反应判断下列叙述中正确的()
| A.PbO2是电池的负极 |
B.负极的电极反应式为:Pb + SO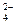 - 2e— - 2e— PbSO4↓ PbSO4↓ |
| C.PbO2得电子,被氧化 |
| D.电池放电时,溶液酸性增强 |
已知:4NH3 (g)+5 O2(g) 4NO (g)+6 H2O (g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO (g)+6 H2O (g);该反应是一个可逆反应,正反应是放热反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A B C D
下列说法正确的是( )
| A.90℃时,纯水的pH等于7 |
| B.已知一种c (H+)=1×10-3mol/L的酸和一种c (OH-)=1×10-3mol/L碱溶液以等体积混合后,溶液呈酸性,其原因是浓的弱酸和稀碱反应所致 |
| C.配制FeCl3溶液,为了抑制水解,常加稀硫酸 |
| D.在Na2S溶液中,离子浓度的关系是:c (Na+)>c (S2-)>c (HS-)>c (OH-)>c (H+) |
在一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)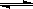 2C(g)达到平衡的标志的是()
2C(g)达到平衡的标志的是()
①C的生成速率是B的生成速率的2/3倍 ②单位时间生成a mol A,同时生成3a mo1B ③A、B、C的浓度不再变化 ④混合气体的总压强不再变化
⑤混合气体的物质的量不再变化 ⑥单位时间消耗 a mol A,同时生成3amolB
⑦A、B、C 的分子数目比为1∶3∶2
A.②⑦ B.⑥④ C.①③ D.⑤⑥