有一包固体物质,可能含有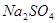 、
、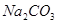 、
、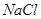 、
、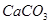 、
、 、
、 中的一种或几种,现做如下实验。请填空回答其中的问题:
中的一种或几种,现做如下实验。请填空回答其中的问题:
(1)将此固体充分溶解于水中,得到白色沉淀,上层为无色溶液;过滤后,在白色沉淀中滴加足量稀硝酸,未见沉淀溶解。由此可知,原固体物质中一定含有 ,可能含有 。
(2)为确定原固体物质中“可能含有”的物质是否存在,现取3.5g原固体,充分溶于水中,将得到的白色沉淀洗涤、烘干后称量,质量为2.33g。通过计算确定:“可能含有”的物质 (选填“一定存在”、“一定不存在”或“仍不能确定是否存在”)。
含硫化合物的种类很多,现有SO2、Na2SO3、H2SO4、CuSO4四种常见的含硫化合物。
回答下列问题:
(1)将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是。
| A.S2- | B.S | C.SO32- | D.SO42- |
(2)亚硫酸钠中的硫呈+4价,它既有氧化性又有还原性,现有试剂:溴水、H2S、稀硫酸。请选取合适的试剂证明Na2SO3具有还原性。
所选试剂是____________,该反应的离子方程式为:。
(3)常温下,将铁棒置于浓硫酸中,无明显现象,有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面,则发生了钝化;若铁棒表面,则未发生反应。
(4)用铜制备CuSO4溶液,可设计以下三种途径:
写出途径①中反应的离子方程式,最佳途径是__________(填序号),理由是。
Cl2是一种重要的化工原料,下图是一些含氯产品。
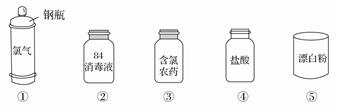
(1)①中钢瓶上应贴的标签为_____________。
A.腐蚀品 B.爆炸品C.有毒品 D.易燃品
(2)下列有关漂白粉和漂白液的说法正确的是___________。
A. 漂白粉是纯净物,漂白液是混合物
B. 漂白粉的有效成分是Ca(ClO)2
C. 工业上将氯气通入澄清石灰水制取漂白粉
D. 漂白液的有效成分是Na2O2
(3)工业上利用Cl2制盐酸,其化学方程式为____________________________。Cl2溶于水可制得氯水,检验一瓶氯水是否已经完全变质,可选用的试剂是_____________。
A.硝酸银溶液B.酚酞溶液C.碳酸钠溶液 D.紫色石蕊溶液
(4)将8.7 g MnO2与足量浓盐酸混合加热,反应生成氯气的体积(标准状况)是_________L;被氧化的HCl的质量是_____________g。
(5)下图是实验室用KMnO4与浓盐酸制取适量氯气的简易装置。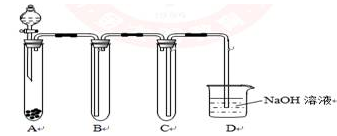
装置B、C、D的作用分别是:
B___________________________________________________;
C___________________________________________________; D___________________________________________________。
G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,其合成路线如下: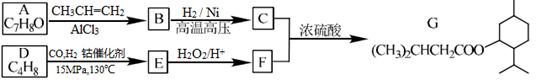
已知:
①A能与FeCl3溶液发生显色反应
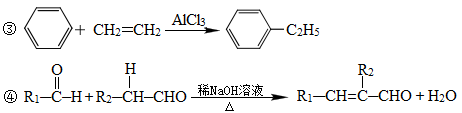
(1)A的结构简式为。
(2)C烃基上的一氯代物有种(不考虑立体异构)。
(3)D分子中含有种不同化学环境的氢原子。
(4)写出同时符合下列条件的A的所有同分异构体的结构简式(不考虑立体异构):。
a.分子中有6个碳原子在一条直线上
b.分子中含一个—OH
(5)正戊醇可用作香料、橡胶促进剂等,写出以乙醇为原料制备CH3(CH2)3CHO的合成路线流程图(无机试剂任用)。合成路线流程示意图示例如下: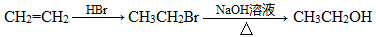
据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①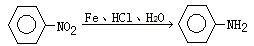 (苯胺,弱碱性、易氧化)
(苯胺,弱碱性、易氧化)
②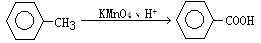
下面是PAS—Na的一种合成路线(部分反应的条件未注明):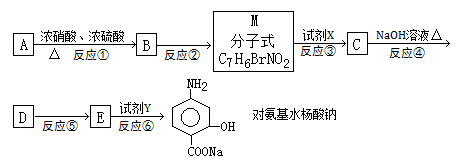
(1)A与浓硝酸和浓硫酸的混合物可以发生取代反应,在30℃时反应主要得到B和它的一种同分异构体,在一定条件下也可以反应生成TNT,请写出A制取TNT的化学方程式:,TNT的系统命名法为。
(2)写出反应②的化学方程式,注明反应条件并配平:。
(3)本题中的中间产物M的官能团的名称为,与题中M具有相同官能团的同分异构体并属于芳香族化合物的共有种(不含M本身)(不考虑立体异构)。
(4)反应①的反应类型为。
(5)试剂X为,试剂Y为。
关于金属的冶炼和应用,有以下一些问题,请按要求回答问题。
(1)工业制备铝一般是通过铝土矿制得纯净的Al2O3,然后电解Al2O3/Na3AlF6得到铝。也可用电解NaCl—KCl—AlCl3共熔体方法制铝,且比电解Al2O3/Na3AlF6制铝节省电能约30%,但现在仍用前一种方法制铝,其原因可能是()(填序号)
A.AlCl3是共价化合物,其熔融体不导电
B.电解AlCl3生成的Cl2会污染大气
C.自然界不存在富含AlCl3的矿石,故此方法所用流程较繁琐
D.生产无水AlCl3较困难,此方法总成本比另一种方法高
(2)把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为()(填序号)
A.1∶2∶3B.3∶2∶1C.6∶3∶1D.6∶3∶2
(3)航母螺旋桨主要用铜合金制造。为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合下图的信息推断该合金中除铜外一定含有(填化学式)。
(4)1.92 g铜和一定量的浓硝酸反应,随着铜的不断减少,反应生成的气体颜色逐渐变浅,当Cu全部反应时,共收集到标准状况下气体1.12 L(无N2O4),则反应中消耗HNO3的物质的量是。