在一个密闭容器中用等物质的量的A和B发生反应:A(g)+3B(g)  2C(g),该反应达到平衡时,平衡混和气中A的体积分数为( )
2C(g),该反应达到平衡时,平衡混和气中A的体积分数为( )
| A.50% | B.60% | C.70% | D.无法计算 |
下列各图示实验操作合理的是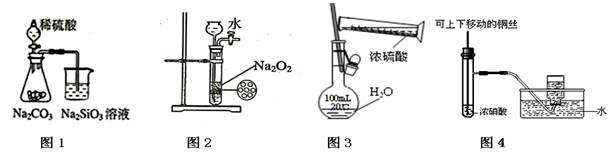
| A.图1为证明非金属性强弱:S>C>Si |
| B.图2为制备少量氧气 |
| C.图3为配制一定物质的量浓度的硫酸溶液 |
| D.图4为制备并收集少量NO2气体 |
下列物质间的转化在给定条件下不能实现的是
| A.①②③ | B.①②④ | C.①②③④ | D.①②③④⑤ |
【改编】短周期主族元素A、B、C、D、E的原子序数依次增大,其中A与C同主族,A与其它元素不在同一周期,B与D同主族,常温下D的单质为淡黄色固体。下列推断中正确的是
A.离子半径由小到大的顺序:r(B)<r(C)<r(E)
B.元素B、D分别与A形成的化合物的热稳定性:D>B
C.元素D的氧化物对应水化物的酸性比E的弱
D.元素B与A形成的某种化合物和B与C形成的某种化合物反应,可能包含了离子键与共价键的断裂和形成
【原创】化学与社会、社会密切相关,下列说法正确的是
| A.工业上利用二氧化硅在高温条件下与焦炭反应,生成单质硅和二氧化碳的原理,制取粗硅 |
| B.手指不慎被玻璃划伤流血,可向伤口上涂FeCl3溶液,是因为FeCl3溶液可杀菌消毒 |
| C.2014年山东莱芜共出现284天雾霾天气,对煤进行液化和气化等物理变化的处理,可减少雾霾天气的发生 |
| D.白酒放置一定时间香味更浓,是因为白酒中乙醇与少量的有机酸反应生成具有香味的酯 |
【原创】在一定条件下,将2mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s)。2 min末该反应达到平衡,并测得B的浓度为0.3 mol·L-1,C的浓度为0.6mol/L,下列说法正确的是
xC(g)+2D(s)。2 min末该反应达到平衡,并测得B的浓度为0.3 mol·L-1,C的浓度为0.6mol/L,下列说法正确的是
| A.可以根据容器内压强是否变化来判断是否平衡 |
| B.B的平均反应速率为0.3 mol/(L·min) |
| C.平衡时K=0.5 |
| D.若升高温度,则C消耗的速率加快 |