“封管试验”具有简易、方便、节约、绿色等优点。观察下列四个“封管试验”(夹持装置未画出),判断下列说法正确的是
| A.加热时,a上部聚集了固体NH4Cl,说明NH4C1的热稳性比较好 |
| B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体 |
| C.加热时,c中溶液红色变深,冷却后又变浅 |
| D.水浴时,d内气体颜色变浅,e内气体颜色加深 |
一定条件下,由A、B两种有机物组成的气态混合物,无论A、B的含量如何变化,完全燃烧10 mL这种混合物,消耗O2的量都不改变。这两种有机物可能是( )
A.C2H6O C2H4 B.C2H4O C2H4 C.C2H4O2 C2H6 D.C2H4O C2H2
关于丙烯醛(CH2==CH—CHO)的叙述不正确的是( )
| A.可使溴水和KMnO4酸性溶液褪色 | B.与足量的H2加成生成丙醛 |
| C.能发生银镜反应 | D.在一定条件下可氧化成酸 |
已知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在同一平面上的是()
A.苯乙烯 |
B.苯甲酸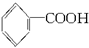 |
C.苯甲醛 |
D.苯乙酮 |
某学生做乙醛还原的实验,取1 mol·L-1的硫酸铜溶液2 mL和0.4 mol·L-1的氢氧化钠溶液4 mL,在一支试管里混合加入0.5 mL 40%的乙醛溶液加热至沸腾,无红色沉淀,实验失败的原因是()
| A.NaOH不够量 | B.CuSO4不够量 |
| C.乙醛溶液太少 | D.加热时间不够 |
茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:
关于茉莉醛的下列叙述错误的是()
| A.在加热和催化剂作用下,能被氢气还原 | B.能被高锰酸钾酸性溶液氧化 |
| C.在一定条件下能与溴发生取代反应 | D.不能与氢溴酸发生加成反应 |