在下列各反应中,盐酸既表现出酸性又表现出还原性的是( )
| A.HCl+NaOH===NaCl+H2O |
| B.Zn+2HCl===ZnCl2+H2↑ |
| C.HCl+AgNO3===AgCl↓+HNO3 |
D.MnO2+4HCl(浓)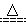 MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O |
我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是
| A.用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离 |
| B.用湿毛巾或蘸有烧碱水的毛巾捂住口鼻撤离 |
| C.向地势低的地方撤离 |
| D.观察风向,顺风撤离 |
对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。下面所列物质,贴错了包装标签的是:
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)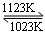 TaI4(g) + S2(g),下列说法错误的是
TaI4(g) + S2(g),下列说法错误的是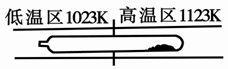
| A.在不同温度区域,TaI4 的量不同 |
| B.在提纯过程中,S2 的量不断增多 |
| C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大 |
| D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
对于可逆反应: 2A(g)+B(g) 2C(g) △H<0,下列各图中正确的是
2C(g) △H<0,下列各图中正确的是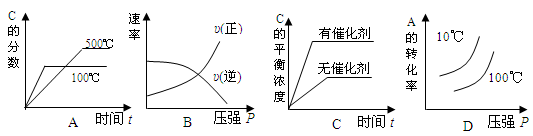
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)。下列说法错误的是
2NH3(g)(正反应为放热反应)。下列说法错误的是
| A.升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量变大 |
| B.升高平衡体系的温度(保持体积不变),混合气体的密度不变 |
| C.当反应达到平衡时,N2和H2的浓度比是 1∶3 |
| D.当达到平衡时,充入氩气,并保持压强不变,平衡将逆向移动 |