下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④的最简单氢化物的电子式为 ,结构式 。
(2)③、⑦、⑧的最高价含氧对应的水化物的酸性最强的是 (填化学式)。
(3)④、⑥、⑦的原子半径由小到大的顺序为 。
(4)由①、②、③、④四种元素可形成多种既含有离子键又含有共价键的化合物,写出其中一种化合物的化学式 。
(5)元素③和元素⑧的氢化物极易溶于水,用两根玻璃棒分别蘸取它们的浓溶液,互相靠近时,可看到大量的白烟,写出产生该现象的化学方程式是 。
(6)用电子式表示②的最高价氧化物的形成过程: 。(7)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体X,其结构中原子的排列为正四面体,请写出X及其同素异形体的名称 、 。
碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知: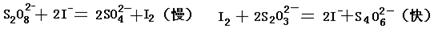
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表: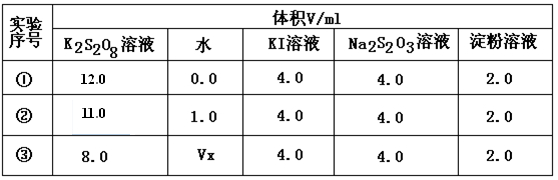
表中Vx=mL,理由是。
已知某条件下,浓度c(S2O82—)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82—)~t的变化曲线示意图(进行相应的标注)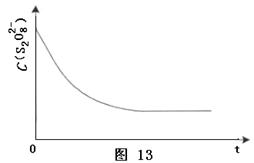
碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为:
2Li(s)+I2(s)="2LiI" (s)△H
已知:4Li(s)+O2(g)=2Li2O(s)△H1
4 LiI(s)+O2(g)=2I2(s)+2Li2O(s)△H2
则电池反应的△H=_______________
(15分) 碳及其化合物有广泛的用途。
(1)反应C(s)+ H2O(g) CO(g) +H2 (g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是。
CO(g) +H2 (g) ΔH=" +131.3" kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是。
| A.增加碳的用量 | B.升高温度 | C.用CO吸收剂除去CO | D.加入催化剂 |
(2)已知,C(s)+ CO2(g) 2CO(g) △H=+172.5kJ•mol-1
2CO(g) △H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g) CO2(g)+H2(g)的△H=kJ•mol-1。
CO2(g)+H2(g)的△H=kJ•mol-1。
(3)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO2(g)+H2(g),得到如下数据:
| t / min |
2 |
4 |
7 |
9 |
| n(H2O)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
① 其它条件不变,降低温度,达到新平衡前v(逆)_____v(正)(填“>”、“<”或“="”)" 。
②该温度下,此反应的平衡常数K=___________;(写计算过程)
(共15分)由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇, 一定条件下发生如下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)写出该反应的平衡常数表达式:K=;已知:K(300℃)>K(350℃),则该反应是_______反应。(填“吸热”或“放热”)
(2)下列情况不能说明该反应一定达到平衡的是(4分)
A.混合气体的平均平均相对分子质量不变 B.混合气体的压强不变
C.单位时间内生成3mol H—H键,同时生成2 mol C=O键
D.混合气体中 c (H2) : c (CH3OH) = 3:1
(3)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为mol·L-1·min-1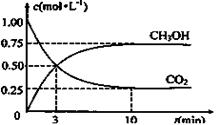
(4)下列措施中能使(3)题中n(CH3OH)/n(CO2)增大的有。(填字母)
A 升高温度 B 加入催化剂 C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
用密度为1.84g/cm3,质量分数为98%的浓硫酸配制100mL 1.00mol/L 的稀硫酸。
(1)在容量瓶的使用方法中,下列操作不正确的是____________
| A.使用容量瓶前检验是否漏水 |
| B.容量瓶用水洗净后,再用待配溶液洗涤 |
| C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
| D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处, 用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(2) 经计算,上述浓硫酸的浓度为_______ mol/L。配制100mL1.00mol/L的稀硫酸,应用量筒量取浓硫酸的体积为_______mL(保留一位小数),量取时应选用_______ (填序号①10mL、②50mL 、③100mL)规格的量筒。
(3)请将下列步骤补充完整:
a.量取所需浓硫酸在烧杯中加适量蒸馏水溶解,待溶液冷却到室温后将其沿玻璃棒移入mL的容量瓶中,并将洗涤液移入容量瓶中。
b.向容量瓶内加水,直到液面接近刻度线cm时,改用小心地加水至溶液凹液面与刻度线相切。
c.将容量瓶盖好瓶盖,摇匀。
⑷配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
转移时未洗涤烧杯,则结果;
所用容量瓶未干燥,则结果;
定容时俯视,则结果。
某金属氯化物MCl227g,含有0.40molCl-,则该氯化物的物质的量为______,摩尔质量为,金属M的相对原子质量为。