某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答: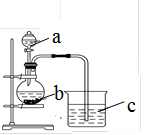
(1)仪器a的名称是 ,
应盛放下列药品中的 (填序号)。
A.稀硫酸 B. 亚硫酸 C. 氢硫酸 D. 盐酸
(2)仪器b应盛放下列药品中的 (填序号)。
A.碳酸钙 B. 硫酸钠 C. 氯化钠 D. 碳酸钠
(3)b中反应的离子方程式为 。
若看到仪器C中的现象是 ,即可证明 比 酸性强(填化学式),得电子的能力 比 强。
已知拆开1 mol H—H键、1 mol I—I、1 mol H—I键分别需要吸收的能量为436kJ、151k J、299k J。则由氢气和单质碘反应生成1 mol HI需要(填“放出”或“吸收”)k J的热量。
下表为元素周期表中的一部分,列出了10种元素在元素周期表中的位置。试用元素符号、离子符号或化学式回答下列问题。
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 第2周期 |
⑥ |
⑦ |
||||||
| 第3周期 |
① |
③ |
⑤ |
⑧ |
⑨ |
⑩ |
||
| 第4周期 |
② |
④ |
(1)10种元素中,化学性质最不活泼的是;(填元素符号)
(2)①③⑤三种元素最高价氧化物对应水化物中,碱性最强的是,(填化学式)该物质内部含有的化学键类型是和;
(3)元素⑦的氢化物的化学式为;该氢化物常温下和元素②的单质反应的化学方程式;
(4)③和⑨两元素形成化合物的电子式是;①和⑦两元素形成四核化合物的电子式是,该物质与CO2反应的化学方程式为;
(5)①和⑤最高价氧化物对应水化物相互反应的离子方程式为:
。
X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布。H2在X单质中燃烧,产生苍白色火焰;Y元素的气态氢化物是H2Y,其最高价氧化物中Y的质量分数为40%;Z元素和氮元素在同一族。
(1)根据以上条件,推断X,Y,Z(填写元素名称);
(2)写出它们的最高价氧化物的水化物的化学式X,Y,Z。
工业上用乙烯和氯气为原料合成聚氯乙烯(PVC)。已知次氯酸能跟乙烯发生加成反应:CH2=CH2+HClO→CH2(OH)CH2Cl。以乙烯为原料制取PVC等产品的转化关系如图所示。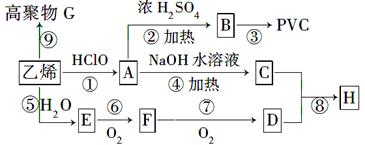
试回答下列问题:
(1)写出有机物B和G的结构简式:B____________,G_________;
(2)②、⑤、⑦的反应类型分别是_______________,_____________,________________;
(3)写出D的一种同分异构体的结构简式_____________;
(4)写出反应⑥的化学方程式__________________________________;
(5)E的核磁共振氢谱有三个峰,峰面积之比为:______________(由小到大)。
(6)写出C与D按物质的量之比为1∶2反应生成H的化学方程式:
______________________________________________________________;
实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某兴趣小组为测定其中NH4HCO3的含量,设计了用在混合物中加酸的实验方法来测定其质量分数。化学小组主要选用了下列药品和仪器进行实验(铁架台等固定仪器未画出)。按气流由左向右的方向,仪器连接顺序是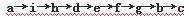 。回答以下问题:
。回答以下问题:
(1)A中加入硫酸溶液的仪器名称是:。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,排除装置中原有的空气。加酸后A装置再次鼓入空气的作用是 。
(3)E装置的作用是 。
(4)实验中,要确保实验中C瓶溶液不褪色,若C瓶中溶液褪色,则测定结果可能会偏 (填“高”或“低”)。
(5)若混合物样品质量为13.1g,充分作用后碱石灰增重4.4g,则混合物中NH4HCO3的质量分数为 。
(6)从定量测定的准确性考虑,该套装置还应作进一步的改进是。