右图所示:2个甲分子反应生成1个丙分子和3个乙分子,对此下列判断不正确的是( )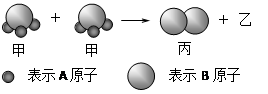
| A.根据阿佛加德罗定律可推知,1个乙分子中含有2个A原子 |
| B.该反应类型是分解反应 |
| C.反应生成的丙物质属于单质 |
| D.化学反应中原子的种类发生了改变 |
下列化合物中含有2个手性碳原子的是
A.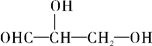 |
B.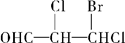 |
C.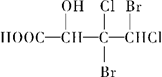 |
D.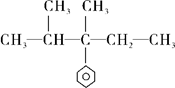 |
同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中一种,吸入会引起慢性中毒,有关二氯甲烷的的说法正确的是
| A.含有非极性共价键 | B.键角均为109°28′ |
| C.有两种同分异构体 | D.分子属于极性分子 |
在乙烯分子中有5个σ键、一个π键,它们分别是
| A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
| C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.氨气分子是极性分子而甲烷是非极性分子 |
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°则BeCl2属于
| A.由极性键构成的极性分子 | B.由极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由非极性键构成的非极性分子 |