下列关于阿伏加德罗常数的说法正确的是:
| A.阿伏加德罗常数是12 g 14C中所含的碳原子数 |
| B.阿伏加德罗常数是 0.012 kg 12C中所含的质子数 |
| C.阿伏加德罗常数是6.02×1023 mol-1 |
| D.阿伏加德罗常数的符号为NA,近似值为6.02×1023 mol-1 |
下列措施,是为了防止产生雾霾的,其中不可行的是
| A.停止冬季供暖,减少有害物质排放 |
| B.对锅炉和汽车等产生的有害气体和烟尘等进行处理 |
| C.退耕还林,改善生态环境 |
| D.寻找新能源,减少化石燃料的使用 |
常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
| A.pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③ |
B.往稀氨水中加水, 的值变小 的值变小 |
| C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+) = C(OH—)+2c(S2—) |
| D.Ca(ClO) 2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强 |
下列图示与对应的叙述相符的是
| A.图甲表示催化剂能改变化学反应的焓变 |
| B.图乙表示向氨水中加水时溶液导电性的变化情况,且溶液c(OH—)大小:a<b |
C.由图丙可知反应2A(g)+B(g)  C(g)的△H >O,且 a=2 C(g)的△H >O,且 a=2 |
| D.图丁表示向CH3COOH溶液中逐渐加入CH3COONa固体后,溶液pH的变化情况 |
一种微生物燃料电池的结构示意图如下所示,关于该电池的叙述正确的是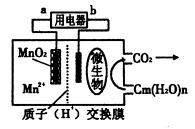
| A.电池工作时,电子由a流向b |
| B.微生物所在电极区放电时发生还原反应 |
| C.放电过程中,H+从正极区移向负极区 |
| D.正极反应式为:MnO2+4H+ +2e— ===Mn2+ +2 H2O |
下列相关工业制法的描述不正确的是
| A.电解熔融氯化钠制取金属钠 |
| B.电解熔融的Al(OH) 3制取金属铝 |
| C.用石英、纯碱、石灰石为原料制玻璃 |
| D.用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 |