25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5kJ/mol、ΔH=-285.8kJ/mol、ΔH=-890.3kJ/mol、ΔH=-2800kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+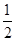 O2(g)===CO(g)ΔH=-393.5kJ/mol O2(g)===CO(g)ΔH=-393.5kJ/mol |
| B.2H2(g)+O2(g)===2H2O(g)ΔH=+571.6kJ/mol |
| C.CH4(g)+2O2(g)===CO2(g)+2H2O(g)ΔH=-890.3kJ/mol |
D.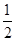 C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l)ΔH=-1400kJ/mol C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l)ΔH=-1400kJ/mol |
氢离子浓度相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确的是()
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B ④反应过程的平均速率B>A ⑤盐酸里有锌剩余 ⑥醋酸里有锌剩余
| A.③④⑤ | B.③④⑥ | C.②③⑤ | D.②③⑤⑥ |
下列叙述正确的是()
| A.95℃纯水的pH<7,说明加热可导致水呈酸性 |
| B.pH=3的醋酸溶液,稀释至10倍后pH=4 |
| C.0.2mol/L的盐酸,与等体积水混合后pH=1 |
| D.由强酸、强碱等物质的量反应得到的溶液pH=7 |
常温下,在水电离出的c(H+)=10-14mol/L的溶液中,一定能大量共存的()
| A.K+、Na+、HCO3-、Cl- | B.K+、Br-、AlO2-、Cl- |
| C.SO42-、Na+、NO3-、Cl- | D.SO42-、NH4+、Al3+、Cl- |
与纯水的电离相似,液氨中存在着微弱的电离:2NH3 NH4++NH2-。据此判断以下叙述中错误的是()
NH4++NH2-。据此判断以下叙述中错误的是()
| A.液氨中含有NH3、NH4+、NH2-等粒子 |
| B.一定温度下液氨中c(NH4+)、 c(NH2-)是一个常数 |
| C.液氨的电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-) |
| D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-) |
醋酸溶液中存在电离平衡:CH3COOH  H++CH3COO-,下列叙述不正确的是()
H++CH3COO-,下列叙述不正确的是()
| A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B.0.10mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小 |
| C.CH3COOH溶液中加入少量的CH3COONa固体,平衡逆向移动 |
| D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |