对于0.1mol·L-1的Na2S溶液,下列判断正确的是 ( )
| A.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-) |
| B.c(Na+)=2c(S2-)+c(OH-)+c(HS-) |
| C.向Na2S溶液中加水稀释,其所有离子的浓度都减小 |
| D.向溶液中加入少量NaOH固体,能促进水的电离 |
在密闭容器中充入一定量的NO2,发生反应2NO2(g) N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是()
N2O4(g) ΔH=-57 kJ·mol-1。在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是()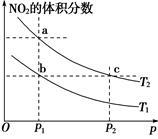
| A.a、c两点的反应速率:a>c |
| B.a、b两点NO2的转化率:a<b |
| C.a、c两点气体的颜色:a深,c浅 |
| D.由a点到b点,可以用加热的方法 |
处于平衡状态的反应2H2S(g) 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下合理的说法是()
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下合理的说法是()
| A.加入催化剂,反应路径将发生改变,ΔH也将随之改变 |
| B.升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C.增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D.若体系恒容,注入一些H2后达新平衡,H2浓度将减小 |
下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是()
| A.Cu能与浓硝酸反应,而不与浓盐酸反应 |
| B.Cu与浓硝酸反应比与稀硝酸反应快 |
| C.N2与O2在常温、常压下不反应,放电时可反应 |
| D.Cu与浓H2SO4能反应,而不与稀H2SO4反应 |
下列有关热化学方程式的书写及对应的表述均正确的是()
| A.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量。则Fe(s)+S(s)==="FeS(s)" ΔH=-95.6 kJ·mol-1 |
| B.稀醋酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1 |
| C.已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1 |
| D.已知2C(s)+O2(g)==="2CO(g)" ΔH=-221 kJ·mol-1,则可知C的燃烧热ΔH=-110.5 kJ·mol-1 |
为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1 mol·L-1)反应过程中的热效应,实验测得如下数据:
| 序号 |
35 mL试剂 |
固体 |
混合前 温度/℃ |
混合后 温度/℃ |
| ① |
水 |
2.5 g NaHCO3 |
20.0 |
18.5 |
| ② |
水 |
3.2 g Na2CO3 |
20.0 |
24.3 |
| ③ |
盐酸 |
2.5 g NaHCO3 |
20.0 |
16.2 |
| ④ |
盐酸 |
3.2 g Na2CO3 |
20.0 |
25.1 |
由此得出的结论正确的是()
A.Na2CO3溶液与盐酸的反应是吸热反应
B.NaHCO3溶液与盐酸的反应是放热反应
C.20.0℃时,含3.2g Na2CO3的饱和溶液和35mL盐酸混合后的温度将低于25.1℃
D.20.0℃时,含2.5g NaHCO3的饱和溶液和35mL盐酸混合后的温度将低于16.2℃