将1molCH4与氯气发生取代反应,待反应完全后,测定四种有机物的物质的量相等,则产生HCl的物质的量是( )
| A.0.5mol | B.2 mol | C.2.5mol | D.4mol |
在硫酸铝、硫酸钾和明矾的混合溶液中,如果SO42-的浓度为0.2 mol·L-1,当加入等体积0.2 mol·L-1KOH溶液时,生成的沉淀恰好完全溶解,则反应后混合溶液中K+的浓度约是(忽略溶液中少量的H+和OH-)()。
| A.0.125 mol·L-1 | B.0.225 mol·L-1 |
| C.0.250 mol·L-1 | D.0.450 mol·L-1 |
设NA为阿伏加德罗常数,下列说法不正确的是()。
| A.1.5 mol NO2与足量的H2O反应,转移的电子数为NA |
| B.常温常压下,0.5NA个CO2分子质量为22 g |
| C.28 g氮气所含的原子数目为NA |
| D.在标准状况下,0.5NA个氯气分子所占体积是11.2 L |
下列关于物质的量的叙述中,正确的是()。
| A.1 mol任何物质都含有6.02×1023个分子 |
| B.0.012 kg12C中含有约6.02×1023个碳分子 |
| C.1 mol水中含有2 mol氢和1 mol氧 |
| D.1 mol Ne中含有6.02×1024个电子 |
设NA为阿伏加德罗常数的数值,下列叙述错误的是()。
| A.标准状况下,11.2 L氢气中含有1 mol质子 |
| B.12 g金刚石含有的共价键数为4NA |
| C.46 g NO2和N2O4混合气体中含有原子总数为3NA |
| D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子 |
下列说法中正确的是()。
| A.6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同 |
B.某金属阳离子的结构示意图为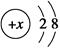 ,其与Cl-形成的强电解质都是离子化合物 ,其与Cl-形成的强电解质都是离子化合物 |
C.二硫化碳是直线形非极性分子,其电子式为 |
| D.中子数为18的氯原子可表示为18Cl |