某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应。
(1)配制100g质量分数为8%的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为 g,水的体积为 mL(水的密度近似看作1g/cm3)。
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的 盘,称量其质量。然后按需要添加砝码、移动游码,再将氢氧化钠固体加入烧杯中,直至天平平衡。该步骤中用烧杯而不用纸称量氢氧化钠的原因是 。
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
【实验方案】
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且最终小至小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
①用pH试纸测定NaOH溶液pH时,正确的操作是: 。
②简述强调“测得的pH小于7”的理由: 。
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。该组同学在没使用温度计的情况下,通过下图所示装置完成了实验。则该组同学根据 
构建知识网络是一种重要的学习方法。下图是关于氢氧化钠化学性质的知识网络,“──”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,A、C属于不同类别的化合物。完善这个知识网络: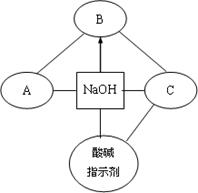
(1)写出A、B、C的化学式:A;B;C。
(2)写出由NaOH转化成B的化学反应方程式:。
分类就是按照种类、等级或性质分别归类。依据不同的分类标准,结论也不尽相同。下列每组中有一种物质具有特殊的组成或性质,而其他两种物质的组成或性质相似。请你利用所学知识将其区分出来并说明理由。
| 化学式 |
被区分的物质(名称) |
理由 |
| Na2CO3、CaCO3、NaCl |
NaCl |
|
| C、CO2、H2CO3 |
单质 |
下图是水分子分解示意图。从示意图中,你能够得出的规律或者结论有:(答出两条即可)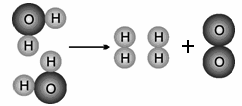
(1);
(2)。
漂白粉是常用的消毒剂。其主要成分是氯化钙(CaCl2)和次氯酸钙[Ca(ClO)2],它是白色粉末,具有强烈氯气味,易吸水,化学性质不稳定,遇有机物或遇热可引起燃烧。用于棉织品及纸浆的漂白、污水处理、蔬菜瓜果及自来水消毒、环境卫生等,亦用于制药、脱色等。
(1)次氯酸钙属于(选填“有机物”或“无机物”)。
(2)根据内容归纳出漂白粉的物理性质。
(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出该反应的化学方程式:
化学用语可准确、简洁地记录、表达和交流化学信息。请用文字或化学符号填写:
(1)4个铜离子;
(2)3个铁原子;
(3)氧元素 ;
(4)食盐水中的溶质