常温下,某溶液中由水电离产生的c(H+)=10-12 mol/L。该溶液中一定能够大量存在的离子组是( )
| A.Ba2+、Na+、Cl-、NO3- | B.Ba2+、Al3+、SO42-、Br- |
| C.NH4+、K+、HSO3-、CO32- | D.Na+、K+、NO3-、I- |
在2A+B 3C+4D中,表示该反应速率最快的是 ( )
3C+4D中,表示该反应速率最快的是 ( )
A.v(A)=0.5 mol/(L·s) B.v(B)=0.3 mol/(L·s)
C.v(C)=0.8 mol/(L·s) D.v(D)=1 mol/(L·s)
下列反应中生成物总能量高于反应物总能量的是()
| A.碳酸钙受热分解 | B.乙醇燃烧 |
| C.铝粉与氧化铁粉末反应 | D.氧化钙溶于水 |
同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是()
| A.密度比为16∶11 | B.密度比为11∶16 |
| C.体积比为16∶11 | D.体积比为1∶1 |
在标准状况下,若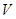 L甲烷中含有的氢原子个数为
L甲烷中含有的氢原子个数为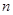 ,则阿伏加德罗常数可表示为()
,则阿伏加德罗常数可表示为()
A. |
B.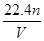 |
C.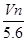 |
D.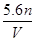 |
配制250mL 0.10mol/L的NaOH溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
| A.转移溶液后未洗涤烧杯和玻璃棒就直接定容 |
| B.在容量瓶中进行定容时仰视刻度线 |
| C.在容量瓶中定容时俯视刻度线 |
| D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度 |